Kolligatív tulajdonságok - studopediya
Tanulmányozása után ebben a témában, köteles:
- van egy megértsük ezeket a fogalmakat és jelenségeket:
- ozmózis, ozmotikus nyomást (a törvény van't Hoff), annak szerepét.
- Raoult törvénye a nyomás az oldószer gőz az oldat feletti és a változás a forrásban lévő, fagyasztás megoldások (velejárója Raoult-törvény).
Kolligatív tulajdonságok - olyan tulajdonsága, melyek nem függnek a természetétől oldott részecskék és csak attól függ a részecskék koncentrációja az oldatban.
Kolligatív tulajdonságok a híg oldatok a következők:
- ozmózisnyomás (van't Hoff)
- telített oldószer gőznyomása az oldat feletti (Raoult törvénye)
- oldat forrási hőmérséklete (1sledstvie a Raoult-törvény)
- oldat kristályosodási hőmérséklete (2 következménye Raoult-törvény)
tulajdonságok nonelectrolytes
Ozmózis úgynevezett spontán mozgása az oldószer-molekulák egész egy féligáteresztő membrán oldatból koncentrációban oldatban nagyobb koncentráció. Ennek eredményeként, a szivárgás ozmózis ozmotikus nyomása az oldat. Hipertóniás oldat úgynevezett az oldat, amelyben az ozmotikus nyomás nagyobb. Hipotóniás oldatban - oldat alacsonyabb ozmotikus nyomás. Izotóniás oldatok - a megoldás az azonos mennyiségű ozmotikus nyomás.
A növényi sejt (C>) (intracelluláris oldat)
Külső környezet (C <) (межклеточный раствор)
Van't Hoff, tanulmányozza a függését az ozmotikus nyomás a külső tényezők találtuk, hogy nem természetétől függ az oldott anyag és csak attól függ, a részecskék száma az oldatban, és a hőmérséklettől:
Rosma = smrt. ahol Rosma [kPa], T [K] - abszolút hőmérséklet, R = 8,32 kJ / mol - egyetemes gázállandó, See - moláris koncentrációja az oldat [mol / l].
A ozmózisnyomása tartalmazó oldat számos anyagot az összege az ozmotikus nyomás által okozott mindegyik.
A nyomás a telített gőzök az oldat fölötti (Raoult törvénye):
A relatív csökkenése a telített gőz nyomása az oldat felett egyenesen arányos a móltörtje az oldott anyag:
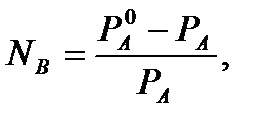
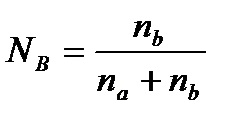
. ahol na. nb - móljainak száma az oldószer (a) és az oldott anyag (b).
A legnagyobb gyakorlati haszna kapott I, II következménye Raoult törvény.
Azt következménye Raoult törvény. Növelése visszafolyatási hőmérsékleten az oldat egyenesen arányos a moláris koncentrációja az oldott anyagok: Dtkip = Keb. Cm. ahol a felhevített Dtkip = T r-RA - t forralás H2 O, 0 ° C; Keb - ebulioskopicheskaya oldószert állandó (Keb H2O); Sm molal az oldott anyag koncentrációja mol / 1000 g oldószerben.
II következménye Raoult törvény. csökkenti a fagyáspontot az oldat egyenesen arányos a moláris koncentrációja az oldott anyagok: Dtzam = Kkr. Cm. ahol Dt = t zam.n2 körülbelül - t ra helyettes kerületi. 0 ° C; Kkr - oszmométerek oldószert állandó (Kcr H2 = kb 1,86); Sm molal az oldott anyag koncentrációja mol / 1000 g oldószerben.
Lásd Rosma = R T = Dtkip Cab Dtzam cm cm = Kcr
Kolligatív tulajdonságai oldatok molekuláris
Megjegyzés: Lásd a 7. függelék - „cryoscopic állandók egyes oldószerek” 8. melléklet - „Ebulioskopicheskie állandók bizonyos oldószerek.”.
Ezek az egyenletek érvényesek csak megoldások, amelyekben nincs a szemcsék közötti kölcsönhatások, azaz az ideális megoldás. Az igazi megoldások fordulnak elő intermolekuláris kölcsönhatások molekulái között az anyag és egy oldószer, ami oda vezethet, hogy disszociációs vagy eljárások, vagy a folyamatok molekuláris egyesület. A disszociációs molekulák az anyag a vizes oldatban jellemző erős elektrolitok. Ennek eredményeként a disszociációja a részecskék számát növeli.
Ratio (i) a kapott részecskéket úgy definiáljuk, mint az arány a teljes részecskék száma a kezdeti molekulák számát. Ez attól függ, a disszociációs mértéke az elektrolit és a részecskék száma, amelybe a molekula:
i = (n -1) a + 1 i - úgynevezett izotóniás együttható. N - részecskék száma (ionok), amelybe a molekulán, egy - disszociációfok (a frakciók).
Rosma ISM R T = Dt = i Cab melegítjük Dtzam cm cm = i Kcr
Kolligatív tulajdonságok oldatok elektrolitok
Példák Forráspont számítások, fagyasztás, ozmotikus nyomás oldatok különböző koncentrációjú.
Példa 1. Számítsuk ki a fagyáspont, forrásban lévő etanol oldat koncentráció (w), 40% -kal egyenlő.
Megoldás: kiszámítjuk az oldat fagyáspontja II alapján a vizsgálat Raoult-törvény: Dtzam = Kkr. Cm, azonban, hogy foglalkozzanak a szükségességét, hogy mozog az egyik fajból a másikba koncentráció:
w [m a szigeteken, r \ r-RA 100g] ® Cm [n mól \ 1000 g p-la]
1. folytassa tömeg vesch Islands (m) móljainak a (n) keresztül aránya:
1 mól C 2H 5OH ------- tartalmaz 46 g
vagy a általános képletű X (n) = = mol / 100R-PA
2. folytassa tömeg a megoldást a súlya a oldószer:
m-p = p m-Ra - m a szigeteken = 100 - 40 = 60 g p-la
2. arányban kifejezett Cm:
0,87 mól C 2H 5OH tartalmaz 60 g oldószert
X (Cm) = 14,5 mol / 1000 g p-la
4. képlet Dtzam = Kkr. Cm találni Dt: Dt = 1,86. 14,5 0 C = 26,97
5. Dt = tzam H2O - tzamr Mr. Þ tzam r-RA = tzam H2O - Dt = 0-26,97 -26,97 0 = C - fagyasztás hőmérséklet 40% -os etanol-oldattal.
Kiszámítjuk az oldat forráspontja I alapján a vizsgálat Raoult-törvény: Dtkip = Keb. Cm, Cm = 14,5 mol / 1000R középső (cm. Felett)
Képletből találunk Dt: Dt = 0516. = 0 7,48 14,5 C
Dt = tkipr-ra - forráspont H2O Þ B.P. pa = p-H2 B.P. mintegy Dtkip + = 100 + 7,48 = 107,48 0 C- forrásban lévő 40% -os etanol-oldattal.
2. példa koncentrációjának kiszámításához sóoldattal (NaCl) izotóniás ozmózisnyomás vér egyenlő „800 kPa. A disszociációs mértéke NaCl veszi 90%.
Megoldás: Rosma elektrolit oldatok (NaCl) = i · lásd · R · T Þ
Feltételek izotonicitást jelenti Rosma (NaCl) = vér Rosma = 800 kPa,
i = (n-1) · A + 1 = (2 - 1) · 0,9 = 1,9
NaCl Û Na + + Cl -. ahol n = 2, a = 0,9
Behelyettesítve a kapott értékeket a képletben (1) Lásd = 0,17 mol / liter - nátrium-klorid-koncentrációt, amely létrehoz egy ozmotikus nyomása 800 kPa.