Mi az elektrolízis?
A hétköznapi életben gyakran halljuk az elektrolízis szóját. De nem mindenki tudja, mit jelent.
Az elektrolízis fizikai-kémiai folyamat. Ennek során egy állandó elektromos áram folyik az elektroliton.
Az elektrolízis során a pozitív töltésű elektróda neve anód. A negatív töltésű - a katód. Az elektrolitban lévő részecskék mozgatását ionoknak nevezik. Az elektrolízis során a pozitív ionkationok - a katódra költöznek, a negatív ionok - anionok - az anódra költöznek.
Leggyakrabban a hétköznapi életben az elektrolízis szó a víz elektrolízisét jelenti. Ez egy olyan folyamat, amelyben a víz hidrogénnel és oxigénnel eloszlik elektromos áram segítségével. Ezt a következő kémiai reakció jellemzi.
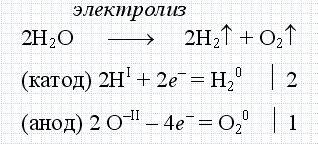
Az elektrolízis folyamatát igen széles körben használják a mérnöki és az iparban. Például, kizárólag elektrolízis segítségével alumíniumot állítanak elő ma. Éppen ezért ez a termelés magas energiaköltségekhez kapcsolódik.
Az elektrolízist leíró fő fizikai törvények Faraday törvényei.
1832-ben Faraday megállapította, hogy az elektródában felszabaduló anyagok tömege közvetlenül arányos az elektroliton átmenő elektromos töltéssel:
ha állandó áramot vezetünk át az elektroliton keresztül egy t időtartamra az I. áramerősséggel.
Arányossági tényező
k az anyag elektrokémiai egyenértékének nevezzük. Numerikusan megegyezik a kibocsátott anyag tömegével, amikor egy elektromos töltés áthalad az elektroliton, és az anyag kémiai természetétől függ.
Ezt a törvényt Faraday első törvényének hívták.
Faraday második törvénye:
Az ion kémiai ekvivalense az ion moláris A tömegarányának aránya z. Ezért az elektrokémiai egyenértékű.
A második Faraday-törvény a következő formában íródott:
ahol
M - moláris tömege az anyag képződik (de nem feltétlenül fejlődött - és ez lehet kezdeni bármilyen reakció után azonnal képződés) miatt elektrolízis, g / mol;
I az anyag vagy anyagkeverék (oldat, olvadék), A;
t az az idő, amikor az elektrolízist végezték, s;
F - Faraday-konstans, Cl-mol-1;
n - az elektronok száma a folyamatban részt vevő, hogy elegendően nagy értékeket a jelenlegi egyenlő az abszolút értéke felelős az ion (és annak ellenion), részt vesz az elektrolízis (oxidált vagy redukált). Ez azonban nem minden esetben lehetséges; például rézsók az elektrolízis oldat (II) képezhetők nem csak szabad réz, de a réz ionok (I) (alacsony áramerősség).