Elektrolitok az emberi testben, medukha
Az elektrolitokkal sókat, savakat, bázisokat értünk, amelyek vízoldatban nagyobb vagy kisebb mértékben disszociálódnak szabad mozgó ionokká.
A nátrium és a klór például a közönséges só kristályaként is ionok formájában van, de ionos rács kötődik. A feloldódás során a disszociáció következtében mobilvá válik, és a rácsszerkezetet vízmolekulák szakítják meg.
Az ionok elektromosan töltött részecskék, amelyek az elektrolitok disszociációja során vizes oldatban mozgékonyak, vízmolekulák blokkolják.
Adjuk például a nátrium-kloridot vízhez, - a nátrium- és klórionok mobilizálódnak. Az egyenáram (3. ábra) területén a pozitív töltésű részecskék mozgatják a katódot (kationokat) negatívan töltve - az anódhoz (anionokhoz).
A Valence megfelel a pozitív vagy negatív töltés értékének.
A szervezet fő kationai:
mEq / L = g / dl X 1,04 (pH 5,08)
Az SI egységek bevezetése után a kationok és anionok koncentrációját mmol / l-ben (1 mmol = relatív atom vagy molekulatömeg mg-ban) jelölik. Egytöltős ionokra (például Na +, K +) az értékek nem változnak (1 mmol = 1 mekv.), Többértékű ionok esetén más (Ca2 +: 1 mmol = 2 meq).
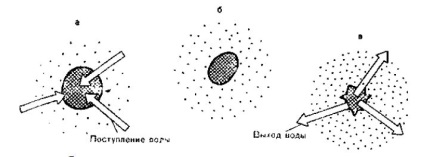
Ábra. 5. Az eritrociták térfogatának változása a különböző koncentrációjú nátrium-klorid oldatok ozmotikus nyomásának függvényében.
a - hipotóniás nátrium-klorid oldat: a vörösvértestek duzzanata szünetig (hemolízis);
b - izotóniás nátrium-klorid-oldat; c - hipertonikus nátrium-klorid oldat;
az eritrociták hullámossága (ráncos alma alakja).
Az ozmolalitás ozmotikus számot jelent 1 kg oldószerre vonatkoztatva, az ozmolalitást 1 liter oldatonként.
Az oldat ozmotikus nyomása az osmotikusan aktív részecskék (ionok és disszociált molekulák) számától függ, amelyek bizonyos térfogatban vannak.
Egység ozmózisnyomás - Osmol vagy mosmmol (milliosmmol). Ha 1 mól glükóz (relatív molekulatömeg 180,2, 1 mol = 180,2 g) 1 kg vizet, ez a megoldás az „ideális” ozmolalitás egyenlő 1 osmmol. Ha hozzá 1 kg vizet 1 mól só (relatív molekulatömeg = 58,4; 1 mól = 58,4 g), majd egy „ideális” 2 osmmol ozmolalitás, mivel a só bomlik nátrium-ionok és a klór, aminek eredményeképpen a glükózzal ellentétben a szemcsék megduplázódnak. Az oldatokat tartalmazó teljesen disszociált sókat, az ozmotikus nyomás leegyszerűsítve meghatározható száma kationok és anionok (ún ideális ozmolalitást). Ugyanakkor természetesen figyelmen kívül hagyják az ion-ion kölcsönhatás, amely befolyásolja az ozmolalitás és vezet a „valódi” ozmotikus nyomást.
Az ozmotikus arányok felelősek a víz eloszlásáért, az ortanizmus különböző folyadéktereiiben (5. ábra, lásd még 1.4.3).
Az ozmotikus nyomást a fagyáspont csökkenésével (osmometria) mérjük.
A plazma ozmolalitása 290 mOsmol (kg víz 38 ° C), (Geigy).
A plazmát főleg szétbontására elektrolitok, a nátrium-a közelítő számítást a plazma felezési meghatározza ozmolalitás. Hatása nem-elektrolitok a normál állapotban enyhén: Glükóz: 100 mg / dl = 5,5 mosmmol / liter plazma (Geigy) -karbamid: 100 mg / dl = 17,2 mosmmol / liter plazma (Geigy) plazma ozmolalitás lehet kiszámítani ezek alapján ábrázolások, ha a nátrium, a karbamid és a glükóz mennyisége ismeretes (Mansberger és munkatársai):
A különbség a számított és mért ozmolalitás bizonyítani jelenlétét az ismeretlen oldott anyagok (toxinok?) És szolgálhat a jelzések a hemodialízis (Mans-Berger et al.).
Alacsony ozmolalitást csak a hyponatremiában figyeltek meg; Ellenkezőleg, a hiperosmolalitás többértékű (Mansberger és munkatársai, hypernatremia, hyperglucosemia, uraemia, ismeretlen anyagok, számos tényező kombinációja).
Gyakorlati célokból a fentiekből levonható, hogy a nátrium nátrium koncentrációja a plazmában meghatározza annak ozmolalitását. Az eltéréseket különösen gyakran cukorbetegség, uremia és ismeretlen oldott anyagok jelenlétében figyelték meg. Ebben az összefüggésben az ozmolalitás pontos mérése minden egyes esetben szükséges.
Hatékony ozmotikus nyomás
A félig áteresztő membránokat az ozmózisnyomás rendellenességeinek meghatározására használják. Azok a anyagok, amelyek részben átjutnak a sejtmembránokon, például a karbamidban, az ozmotikus nyomást csak olyan mennyiségekben tudják eltérni, amelyek zavarják a sejtmembránok permeabilitását. Így a hatékony ozmotikus nyomást csak az igazi ionok termelik.
A normál plazma ozmolalitása (290 mOsmol / kg víz) a tónusosság kiindulópontja.
Az izotóniás oldatok (megközelítőleg):
-1/6 moláris sóoldatok, amelyek molekulái teljesen disszociálnak
2 ionhoz, például 1/6 mólos konyhasó-oldathoz;
- 1/3 moláris oldat, ha az oldószer nem disszociálódik, pl. 1/3 moláris glükózoldat.
Azok a megoldások, amelyek a plazmához képest kevesebb ozmolaritást mutatnak, hipotóniásak; A nagyobb ozmolalitást mutató megoldások hipertóniásak.
A sejtek ozmolaritása megegyezik a plazmaéval [Black, Moore, Burck, 1962]. Figyelembe kell venni, hogy a sejtben lévő elektrolitok egy része független marad. Az oszmotikus nyomást a sejtben folyamatosan befolyásolja az anyagcsere: amikor a nagy molekuláris vegyületek egy bizonyos számú kisebb méretre szétesik, az ozmolalitás növekszik, és a szintézis során csökken.
A kolloid-ozmotikus nyomás megfelel a fehérjék részvételének fokának az ozmolalitásban.
Mivel a fehérjemolekulák nagyon nagyok, az egységnyi tömegre jutó részecskék száma sokkal kisebb, mint az elektrolitok esetében. A plazmafehérjék kolloid ozmotikus nyomása csak 1,6 mOsmol / kg víz (25 Hgmm). Ez a plazma teljes ozmolalitásának 0,55% -a. A legnagyobb hozzájárulás az albumin (85%, Geigy). A plazma kis mennyiségének ozmolaritása ellenére a kolloid ozmotikus nyomás nagy jelentőséggel bír, mivel a fehérjék lassan hagyják el a véráramot. Ebből kifolyólag világossá válik a kolloid-ozmotikus nyomásnak a víz és a közeg közötti folyadék eloszlására gyakorolt hatása. Az albumin koncentrációjának csökkenése például a plazmában csökkenti a víz visszatarthatóságát (hipoproteinémiás ödéma, a keringő vér térfogatának visszanyerése).
Kationok és anionok eloszlása külön folyadéktérben
Amint az 1. ábrából látható. 6, az elektrolitok koncentrációja a test különálló folyadéktérben nem azonos. A plazma és az interstitiális folyadék csak a fehérjetartalmukban különbözik: az intersticiális folyadék 0,4 g / dl fehérjét (Geigy), nyirokforrást tartalmaz - 3,9 g / dl (Groh és munkatársai). De a plazma 6,6- 8,0 g / dl (Geigy). A plazma és az intersticiális folyadék ionösszetételében kisebb különbségeket okoz a Gibbs-Donnan-szakasz.
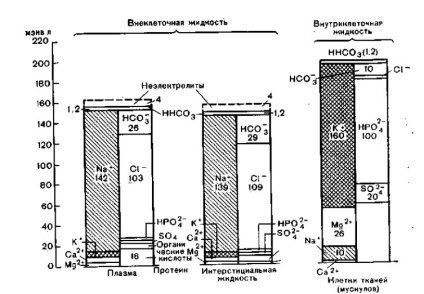
Ábra. 6. A kationok és anionok eloszlása meq / l plazmában vagy intersticiális folyadékban lévő egyes komponensekben és intracelluláris folyadékban meq / kg vízben.
Az úgynevezett monogram formájában jelenik meg, minden oszlop bal felén a kationok, a jobb anionok (Geigy).
Egészen más elektrolit koncentráció intra- és extracelluláris folyadékban terek: az extracelluláris tartalmazott főleg nátrium, a klór és a hidrogén, a sejten belüli - kálium, magnézium, foszfát és szulfát határozzuk meg nagy koncentrációban és a fehérjék.
Az ionok szétválasztásának különbségei a sejtek és az extracelluláris tér között nem csak embereknél, állatoknál és növényeknél léteznek (Rapqport).
Ezek a különbségek a koncentráció poddzrzhivayutsya ellentétes tendencia, hogy szintező miatt diffúzió a membránon keresztül. A koncentráció közötti különbség az akciós potenciál képezi szükséges gerjeszthetőségét idegek és izmok. Megőrzése (a különbségeket a koncentrációban kálium- és nátrium-sejtek között, és extracelluláris tér egy aktív tartalék sejtek összefüggő metabolikus energia, akkor valószínű, fogyasztják irányuló aktív transzport mechanizmusok, nátrium eltávolítjuk a sejteket ( „nátrium-szivattyú”), valamint a felhalmozási kálium (A "káliumszivattyú").