Vízkeménység eltávolítás
Természetes víz rendszerint tartalmaz különböző oldott sókat és egyéb szennyeződéseket, nemkívánatos felhasználásra a víz az ipar és az otthon. A legtöbb esővíz tiszta, de tartalmaz bizonyos mennyiségű különböző anyagokat, Méri áthaladó hangulatot.
A „Víz keménység”
Ideiglenes (karbonát) merevség
Jelenléte miatt a kalcium-és magnézium-hidrogén-karbonátok Ca (HCO3) 2 és Mg (HCO3) 2. A e sók jelenléte a vízben magyarázható felbomlása kalcium-karbonát és magnézium hatására természetes víz és az abban oldott szén-dioxid (szén-dioxid) érintkezve kőzetek (például dolomitot vagy gipsz) tartalmazó ezeket a sókat, például:


A karbonát-keménység az úgynevezett ideiglenes mivel ezek a sók elbontjuk egyszerűen forró vizet.
Állandó keménység
Jelenlétének köszönhetően a vízben, főként kalcium-szulfát és a magnézium-klorid és CaSO 4. MgSO4. CaCl2. MgCl2. A legnehezebb az, hogy távolítsa szulfát CaSO4. miután egy kis oldhatósága.
Az összeg az ideiglenes és állandó keménység lesz a víz összes keménysége:
Magyarországon, a víz keménysége jellemzi száma mg ekvivalens kalcium és magnézium ionokat tartalmazott egy liter vizet. Egy mg ekvivalens (mekv) merevség felel meg tartalma 20,4 mg / l Ca 2+ ionok és 12,16 mg / l Mg2 + ionok (Ca 2+ 20,04 mg és 12,16 mg Mg 2+ - milligramm ekvivalens tömege ezek a kationok, azaz a tömeges 1 10 -3 ekvivalens ezen ionok).
Mivel a víz rendszerint tartalmaz kationok mindkét fém egyidejűleg, a víz keménysége határozza meg a következő kifejezés:
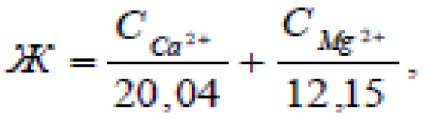
Az 1. táblázat mutatja az értékeket víz keménységét Magyarországon néhány folyó a nyáron.
1. táblázat értékei vízkeménység a nyáron.
Az arány az karbonátot és Állandó vízkeménység határozza meg kőzetek, vízzel mostuk forrása.
A „lúgos víz”
Lúgosság határozza meg a víz mennyiségét a vízben hidroxil ionok és anionok gyenge savak - a szén, a szerves és hidrogén-karbonát és karbonát ionok. Így, az értéke lúgosság egy olyan komponens merevsége által anionok.
Különbséget-hidrogén-karbonát, karbonát és hidrát lúgosság.
Az lúgossága természetes vagy kezelt vizek megérteni a képességét, azok egyes komponenseket, hogy kötődnek a ekvivalens mennyiségű erős savak. A lúgos a víz jelenléte miatt a gyenge sav anionok (karbonátok, hidrogén-karbonátok, szilikátok, borátok, szulfitok, -ditionitek, szulfidok, hidroszulfidok, huminsav anionok, foszfát). Ezek összege az úgynevezett teljes lúgosság. A teljes lúgosság a víz általában így definiált csak szénsav anionok (karbonát lúgosság). Anionok hidrolizálva hidroxid ionok:
CO3 2- + H2 O <=> HCO3 - + OH-
HCO3 - + H2 O <=> H2 CO3 + OH-
Így, lúgosság meghatározott mennyiségű erős sav semlegesítéséhez szükséges 1 dm3 vizet. Lúgosság határozza meg a legtöbb természetes vizek csak hidrogén-karbonátok a kalcium és a magnézium, pH a víz nem haladja meg a 8,3.
Megszüntetése keménység ioncserélő módszerrel
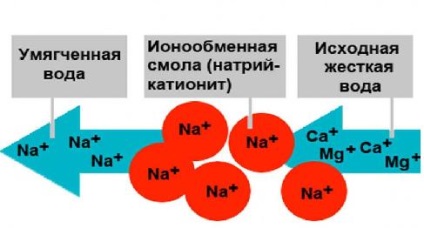
A világban vannak különböző módon eltávolítjuk a keménységet okozó (termikus (forráspont) reagenst, dialízissel, ioncserés). A módszer megválasztása lágyító általában minősége határozza meg a forrás vizet, a szükséges mélységig lágyító és műszaki-gazdasági tényezők. A cégünk gyakori módszer az ioncserélő (kation), ahol vesszük közelebbről, és megállt.
ioncserélő módszer azon alapul, a ioncsere Ca 2+ és Mg 2+. tartalmazott vízben, Na 2+ ionok H + vagy hogy vizet juttatunk át az ioncserélő gyanták.
A kationcserélő gyanta működik, mint egy szűrőanyag. A folyamat a víz eltávolításával keménységű ioncserés tisztítást kationcserélő H leírható az alábbi egyenletekkel:
Az utóbbi esetben, a eltávolítása keménysége képződése kíséri erős sósav, amely korrozív csövek és egyéb fém szerkezetek. Ennek elkerülése érdekében, akkor jobb, hogy használja a Na-kationcserélő gyantát:

Ezek a reakciók azt mutatják, hogy ha nátrium-kationizáció karbonát keménység kezeletlen víz áthalad ioncserélt vízben nátrium-lúgosság. Más szóval, ha a nátrium-kationizáció lúgosság érték nem változik, ami a fő hátránya ennek a folyamatnak. Változatlan is anionos víz összetétele: a víz jelen van az eredeti anionok SO4 2-. Cl - és más teljes egészében átalakult lágyított víz. Ez csak akkor következik be többé-kevésbé teljes cseréje kalcium- és magnézium-kationok, a nátrium-kationok, ahol a merevsége nátrium kationirovannoy víz redukálódik, és a száraz maradékot a kissé növeli.
Lágy víz valamennyi követelményének megfelelő szinte minden iparágak hűtővíz vagy gőz előállítására. Lágy víz alá, minimális feldolgozást, hogy hozzon létre szintetikus szálak, műanyagok, szappanok oldatok, és így tovább. A lágy vizek gátolta életfunkciók a baktériumok, amely lehetővé teszi, hogy csökkentse az adagot a biocid a keringő víz.
Mellett azonban a pozitív tulajdonságait, lágy víz elrejtése számos komoly hátrányai, amelyek közül az egyik egy nagyobb korróziós legfontosabb vízcső anyagokat. Ez annak köszönhető, hogy az ionok hiánya a víz keménysége. Annak megállapítására, maró különböző indexek kerültek kialakításra, beleértve Langelier index és Riznera stabilitást.
Langelier index és a stabilitási index Riznera
Langelier amerikai tudós 1936-ban, hogy értékelje a teljesítmény stabilitást a javasolt megoldás segítségével alapuló képlet meghatározására telítettségének mértéke kalcium-karbonát-oldattal. A instabilitása ez a megoldás képződéséhez vezet a vízkő és korrózió.
Langelier indexszám: pH pH-értékeken.
Annak megállapításához, az index Langelier a következőkre van szükség:
A segédanyagok segítségével együtthatók meghatározva és számított közbenső érték - pH-értékeken.
Langelier index értékek:
Langelier index <0 образования накипи нет, раствор агрессивен (высокая коррозия);
Langelier index = 0 oldat stabil;
Langelier index> 0, ott van a kialakulását skála, korrózió nem figyelhető meg.
Később, 1944-ben. E Rizner megjegyezni, hogy a réteg a skála a fémfelület korrózió megelőzése. Ennek alapján az együtthatók kiszámításának Langelier index Rizner felajánlotta számítási képlete az oldat stabilitását.

Elektrokémiai korrózió csövek

Scale a csővezeték
RSI = 2pHs - pH
2pHs - pH> 6-oldatot hajlamos a korrózióra
2pHs - pH = 6 oldatban stabil
2pHs - pH <6 раствор склонен к образованию накипи
Ennek eredményeként, mind az index lehet csökkenteni egy besorolási kezelést agresszivitás értékelést a 2. táblázatban látható.