Kivonat kézhezvételét diklór-etán, etilén - banki kivonatok, esszék, beszámolók, dolgozatok és
1. Kereskedelmi és technológiai tulajdonságai diklór-etán alkalmazások
Etánban (etilén-klorid) CH2CI-CH2CI - színtelen illékony folyadék egy sajátos szag emlékeztető kloroformmal (forráspontja 83,7 ° C; op -35,3 ° C; párolgáshőjének 77,3 kcal / kg.) . Mivel a víz azeotróp elegyet képez (80,5% diklór-etán), forráspontja 72oS. Diklóretán fények nehezen, világító lángot égések egy zöld peremén, hidrogén-klorid szabadul fel égés közben. Égő diklór-etán könnyen oltható vízzel. diklór-etán párokat alkotnak a levegővel robbanó elegyet kívülről a robbanóképesség 4,8-15,9% (térf.).
Diklóretán elegyedő minden tekintetben alkohol, benzol, aceton és számos más szerves vegyületek; jól oldódik olajok, zsírok, gyanták, viaszok, gumi, alkaloidok, valamint bizonyos szervetlen anyagok, mint például a kén, sárga foszfor, jód, és mások.
Diklóretán mérgező, narkotikus hatású, ezért legyen óvatos, ha foglalkozik velük. Diklóretán gőzök belélegzése fejfájást okoz, irritáció a légutakban, a köhögés és halálhoz vezethet. Maximális megengedhető koncentrációt diklór-etán-gőzök levegőben ipari helyiségek 10 mg / m3.
Diklór-etánt alkalmazunk oldószerként különböző területeken: a kitermelés az zsírok tisztítására olaj és a viasz, a zsírtalanítás gyapjú, és szőrme, valamint a fém termékek előtt krómozás vagy nikkel galvanizáló, a kivonat viaszok (montánviasz) barnaszénből, stb ... ő is egy köztes termék számos ipari szintézisek során. Jelentős mennyiségű diklór-etán-fogyasztás a vinil-klorid.
2. nyersanyagforrások: frakció etilén pirolízis-gáz olaj nyersanyag és koksz frakció etilén gáz.
3. előállítási módszerei diklór-etán.
Számos módja van, így diklór-etán, etilén:
etilént klórral folyékony diklór-etánban 20-30 ° C-on;
Etilén bevezetés folyékony klór megemelt nyomáson és hőmérsékleten nem magasabb, mint 0 ° C;
etilént klórral magasabb hőmérsékleten (120 ° C) feletti különböző katalizátorok (CuCI 2, FeCl3, SbCl 5, szén, stb.) ..;
etilént, hidrogén-klorid és oxigén, mint egy réz katalizátor 300 ° C-on:
CH2 = CH2 + 2HCI + → 0,5O2 SN2Sl-SN2Sl + H2O
Az iparban elsősorban szét első módszer, technológiailag fejlett AF Dobryanskiy alkalmazottakkal. Ezek igazolták a használatát diklór-etán, így nem csak a tiszta etilén hanem ztilensoderzhaschizh keverékei, azaz például etilén-frakció a pirolízis-gáz olaj nyersanyag és koksz-kemence gáz etilén frakciót. A második módszer arra, hogy nagy hozam etilén-diklorid, és szükség erősen koncentrált folyékony klór. Továbbá, diklór-etán képződése reakciót ebben az esetben megy végbe, a klór mindig feleslegben, amelyek kialakulásához vezet nem csak a diklór-etán, de más termékek etilén klórozás. A hátrányok más folyamatok alacsony hozam miatt a kialakulását a-diklór-etánnal szubsztitúciós termékek, valamint a tisztítási nehézségeket diklór-etán.
4.Fizikokohimicheskie alapjait a folyamat, mely során diklór-etán
Az előállítására alkalmas eljárással heterogén diklór-etán komplex reakciót. Irreverzibilis endoterm reakció katalizátor alkalmazása nélkül is alacsony hőmérsékleten.
A reakciót a klór és az etilén kapcsolatot történik a kibocsátás a nagy mennyiségű hőt:
CH2 = CH2 + Cl2 → SN2Sl-SN2Sl? H = - 48 kcal
A készítmény a diklór-etán reagáltatásával etilén és klór folyékony diklór-etánban, amelyek mind a gáz, a reakció hatékonyan folyékony fázisban. E folyamat révén, biztonság érhető el (a gáz halmazállapotú klór és etilén robbanásveszélyes), és javítja a feltételek hőátadás a reakcióelegyből egy hűtőközeg. Visszahúzás reakcióhő nagyban megkönnyítette, és teljesen megszünteti a lehetőségét a helyi túlmelegedést. Továbbá, közül az eljárást autokatalitikusan diklór-etán, és a reakció sebessége lényegesen nagyobb, mint a kölcsönhatás a gáz-halmazállapotú etilén és a klór Amikor etilént klórral, hogy a klór adagolása adduktum a kettős kötés (1,2-diklór-etán), és a helyettesítés képződött - triklór-etán, tetraklór-etán és a magasabb polikloridok:
CH2 = CH2 + 2Cl2 → SN2Sl-SNSl2 + HCI
CH2 = CH2 + 3Cl2 → SNSl2-SNSl2 + 2HCI stb
Szubsztitúciós reakciók gyorsulnak a hőmérséklet növekedésével (ábra. 2). Az ábra azt mutatja, hogy a hőmérsékleten -30 -20e C-on olvad szinte kizárólag diklór-etán, míg +20 ° C-on célszerűen a triklór-etán. A további hőmérséklet-növekedés következik be a mélyebb szubsztitúciós alkotnak tetraklór. Korlátozása folyamat megy végbe kémiai reakció. Ábra szerint. 2, a növekedés hőmérséklet gyorsítja a szubsztitúciós reakció, és a hőmérsékletet csökkentjük, - a kimeneti diklóretán.
A kompozíció a kapott termékek változik élesen, ha a reakcióközeget adjuk szabad oxigén. Ebben az esetben, a kialakulását szubsztitúciós termékek lelassul, vagy akár le. Ennek oka az, hogy a helyettesítési lánc reakciót oxigén jelenlétében van vágva. Ez a tény nagyban egyszerűsíti a technológia diklór-etán termelés. Ezért, az oxigén adagolásával végezhetjük etilént klórral 20-30 ° C-on, és eltávolítja a hőt a reakció hűtés nélkül hideg vízzel sóoldattal kívánt hőmérsékleten 0 ° C alatti Ez egyszerűbbé teszi a hardver tervezési folyamat, és csökkenti a költségeit diklór-etán.
A gátlás mechanizmusa által oxigén szubsztitúciós reakció egy hidrogénatomot egy klóratom pontosan nem tisztázott. Úgy véljük, hogy a kapott klóratomok
Reagálnak az oxigén séma szerint
Cl2 · + O 2 → Cl - O - O ·
Cl - O - O · → Cl ·
CIO · + CIO · → Cl2 + O2, stb
miáltal a klóratomok száma jelentősen csökken.
5. Berendezés technológiai termelési rendszer diklór-etán
Az ipari etilén klórozása előállítására etilén-dikloridot feltételek hajtjuk végre függőleges hengeres chlorinators; A reakcióhőt eltávolítjuk hideg víz kering a tekercsek, és a burkolat egységet. Klórozó színültig töltött diklór-etán, buborékoltatunk keresztül a reagens gázok - etilén és a klór. A gázokat alaposan meg kell üríteni, mert a nedves klór, részlegesen hidrolizált, korrozív hatást gyakorol a acélból készült berendezések. A kellően teljes száradása a kezdeti gáz teljes reakció berendezések és csővezetékek állíthatók elő a szokásos szén-acélból.
Etilént táplálunk a szétválasztása mély hűtés növények elég száraz, és a további szárítás ez nem feltétlenül szükséges. A felszabaduló etilén más eszközökkel, például hypersorption, nedvességet el kell távolítani fagyasztva vagy szilárd szorbensek. Kénsav alkalmazását az etilén kiszáradás nem ajánlott, mert a jelenléte a gyantásodás bekövetkezik, és szulfonálásával telítetlen szénhidrogéneket tartalmazott az etilén frakcióban. Klór használnak szárításra, tömény kénsav, de általában klórt vezetünk klóros növényi már lecsapolt. Amikor dolgozik rosszul lecsapolt gázokat szükség osvintsovyvat chlorinator belső falak, keverővel és hűtőkígyókkal.
Process etánban ipari termelés rendszer ábrán látható. 1. A gázelegy belépő klórozó 1 tartalmaznia kell az etilén feleslegben (5-10% a sztöchiometrikus mennyiség) szükséges a teljes kötési klórt. A klór jelenlétében a reagens gázok elfogadhatatlan például klór- kölcsönhatás szénhidrogének hűtetlen cső növelheti a gyulladási hőmérsékletet és a szénhidrogének. A klór betápláljuk a klórozó, hígított
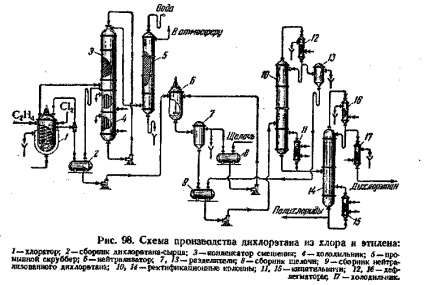
1. ábra. Előállítási reakcióvázlat diklór-etán etilén és klór:
1 - klórozóoszlop; 2 - egy gyűjtemény a nyers diklór-etán; 3 - keverőkondenzátor; 4 - Holo-dilnik; 5 - mosás gázmosó; 6 - átalakító; 7, 13 - szeparátorok; 8 - gyűjteménye alkálifém; 9 - egy gyűjtemény a semlegesített etilén-diklorid; 10, 14 - rektifikáló oszlop; 11, 15 - kazánok; 12, 16 - deflegmátorokat; 17 - hűtőszekrény.
levegő (8-10 térfogat% a reagáló gázok); ez lehetővé teszi, hogy végezzen az etilén klórozása 20-30 ° C-on át
A jobb érintkezés a reagáló gázok és a még teljesebb feloldjuk őket egy klórozó diklóretánban telepített propeller keverővel. A kapott nyers diklór-etánt a klórozó folyamatosan áramlik a gravitáció révén a gyűjtemény 2.
A kipufogógázok a klórozó (nem reagált etilén) gáz-halmazállapotú szennyező anyagok jelen vannak a kiindulási etilén és a klór, levegő) magával sodorja jelentős mennyiségű etilén-diklorid gőzt és egy részét képződő hidrogén-kloridot, mint eredményeként a szubsztitúciós reakciók. Ezért, a füstgázból abszorpcióval vagy diklór-etánban a visszanyert oldószer (kerozin, stb) kondenzációjával, vagy ahogy az ábrán látható. A füstgázokat táplálunk egy csomagolt keverőkondenzátor 3 fölé szerelt holodilyshkom 4. A felső része a keverő kondenzátor tápláljuk a 4 hűtőgép, lehűtjük -20 ° C-on diklór-etánt az öntözés fúvóka. A belépő gázok az alsó része a keverő kondenzátor, tesztelték a fúvóka alulról felfelé ellenáramban diklór-etán és lehűtjük -15 ° C-on, miáltal szinte minden pár diklóretán kondenzálunk. Condensed diklór-etán kevert diklór-etánnal mellékelt öntözésre, és belép a 4 hűtőgép, ahol ismét lehűtjük -20 ° C-on A gázokat kipufogó a tetején a keverőkondenzátor, vízzel mossuk, egy 5 mosóban hidrogén-kloridot, és hagyjuk, hogy légkörbe.
Etánban gyűjteménye nyers 2 pumpálunk a 6 önálló biztonsági egység, ahol a semlegesítést hajtunk végre keverés feloldjuk diklór-etán-hidrogén-kloridot, 5-10% nátrium-hidroxid. A semlegesített diklóretánt elválasztjuk a 7 elválasztó a lúgoldat és csatornába a kollektor 9 a, amelyet betáplálunk szárítás és desztillálás. Szárítás etánban előállított desztillációs oszlop 10, amelynek alját a hőmérsékletet 75-85 ° C-on Az oszlopról azeotrop elegyét diklór-etán ledesztilláljuk a vizet, kondenzáljuk a deflegmátor 12 és részben visszatért refluxig oszlop 10. A desztillátumot rétegzett a szeparátorban a 13.; víz küldött egy tisztítási növényi és tovább a csatornába, és a diklór-etánt visszavezetjük a gyűjtemény 9 A oszlop aljáról 10 áramlik dehidratált diklóretánban belépő tovább a frakcionáló oszlop 14, ahol a desztillátum-diklór-etán triklór-etán és elválasztjuk polikloridok (folyékony fenékterméket).
6. kiszámítása az anyagmérleg etilén klórozási eljárás
Adatok a számításhoz:
Táblázat alapján. 4.1 [1] meghatározza a képződött ciánhidrinek hozama hőmérsékleten 255 K:
Ábra. 2. A hozama reakciótermékek.
Az ábra alapján az. 2, adatkimenetet reakciótermékeket táblázat foglalja össze. 1.
A reakció hozama termékek T = 265K
A kipufogógázok telített gőzök diklór-etán, amelynek a száma lehet kiszámítani a [2] képletű:
ahol - a száma diklóretánt gőz, magával vitt gázok kg / h;
Gg - az összeget a gázok áthaladt diklór-etán, kg / h;
φ - a telítési együttható (ebben az esetben a φ = 1 [2]);
p - gőznyomás felett a folyadék (T = 265 K p = 0,0021 MPa ábra XIV [4]).
MF - molekulatömegű etilén-diklorid;
Mi - tömeg szerinti átlagos molekulatömege a gázkeverék;
F - a teljes hálózati nyomás, MPa.
Azt találjuk, amelynek átlagos molekulatömege a gázkeverék:
Diklóretán gázelnyelés jelentése:
Eltávolítottuk a reaktorból diklóretán folyadék, amelynek összege a következő:
Mass a nyersanyag-felhasználás:
A tömege normál körülmények között gázok egyenlő moláris tömege osztva a által elfoglalt térfogat egy mól, azaz Amennyiben - a gáz sűrűsége normál körülmények között.
egyensúly az eltérés:
, ami egészen elfogadható.
Átalakítása a nyersanyag.
A fő ügynök a nyersanyag etilén, így a továbbítási konverziós etilén, mint az aránya, az etilén fogyasztás (GH-GK) általános GK - mennyisége nem reagált etilén, hogy a teljes összeg elején a folyamat gH:
Szelektivitás találtunk, mint a végtermék aránya Gp Gc az reagált nyersanyag
Hozammal kapjuk a kívánt terméket.
Ha az összeg a cél (védjegy) Gp terméket, F-en alapuló hozam betáplált mennyiség Gz
Lebedev NN Chemistry and Technology, olyan alapvető szerves és petrolkémiai szintézis: Textbook középiskolákban. - M. Chemistry, 1988. - 592 p.
Általános vegyészmérnök: A tankönyv. kémiai-technikai. spec. egyetemeken. A 2 m. / Ed. prof. I.P.Muhlenova. - M. Executive. wk. 1984 - 263 p.
Pavlov, KF Romankiv PG Noskov AA Példák és problémák során eljárások és eszközök kémiai technológia. - L. Chemistry, 1987. - 576 p.
Paushkin YM SV Adelson Vishnjakova STB petrolkémiai szintézis technológiával, két részből áll. I. rész a szénhidrogén nyersanyag és a termékek az oxidációs. M. "Chemistry:", 1973. - 448 o.
A metanol szintézisénél a szén-monoxid és hidrogén. Technológiai tulajdonságai metanol (metil-alkohol). A metanol és a termelés kilátásai. Forrásai nyers metanol: tisztítása szintézis gáz, szintézis, egyenirányító nyers metanol.
Fenolt egy vegyi anyagra, annak használata és jelentősége. Különösen lépéseket előállítására fenol. Rövid leírása A folyamat a termelés révén benzolszulfonsav, klór-benzol, kumol, oxidatív klórozás benzol. Nyersanyagok.
A ammoxidációja propilén és etilén oxidatív klórozás. A főbb jellemzői a folyamatok oxidációs egy fluid ágyas katalizátort. „Air”, és „oxigén” folyamatokat. Recirkulációs technológia. A kinetikája és mechanizmusa reakciók.
Az alapanyag az etanol termelés és az előállítására szolgáló módszerek. Fiziko-kémiai vizsgálata alapvető folyamatait Etilalkohol gyártása. Leírás A technológiai rendszer a termelési folyamat számítás alapvető technológiai paraméterek.
Etilén oxidációs folyamat. Módok, termékek és alaptípusa reaktorokat. Gyártás karbonsavak. Beszerzésének módszerei kaprolaktám primer nyersanyagok (kőolaj, földgáz és szén). Folyamatok dehidroklórozásán a szerves klórtartalmú szintézis.
A koncepció és a lényege, a folyamat a klórozás a szénhidrogének és egyéb vegyületek, a történelem a felfedezése és fejlesztése klórozás tanítások. Előállítási eljárásai a klórozott szénhidrogének és ezek alkalmazása az iparban. Jellemzők és fogadni ftoroalkanov.
A koncepció a oxiránok, természete, és a funkciók jellemző a reakció. Etilén-oxid, mint a legegyszerűbb oxirán, előállítási eljárások, az ipari alkalmazáshoz. Oxidációja alkének szerves persavak intramolekuláris helyettesítése halogénhidrinek.
A védjegyek és tulajdonságainak meghatározása acetilén technológia. Nyersanyagforrások. Kilátásai az eltérő alapanyagok. Ipari előállítására irányuló módszereket. Fiziko-kémiai folyamat előállítására acetilén pirolízisével metán termikus oxidáció.
A koncepció egy halogénezett szénhidrogén, valamint ezek izomerjei és nómenklatúra, általános képletű, valamint eljárás előállítására nevek. Eljárások az halogénezett szénhidrogének, azok alkalmazása az iparban. Karakter hatása klór széntartalmú anyag.
Minisztérium általános és szakmai magyar Oktatási SamGTU Szerves Kémiai Tanszék Tanfolyam etilén és származékai az ipari szerves szintézisekben
Etilén-oxid - az egyik a nagy szerves szintézissel. Fizikai és kémiai tulajdonságai az anyag. A szerkezet a molekula. Gyártása etilén-oxid: szintézise révén klóretanol, etilén-oxidációt. A használata az etilén-oxid.
Vinil-kloridot, mint egy képviselője monogaloidnyh etilénes szénhidrogén-származékok. Előállítására vinil-klorid által Ostrosmyslenskomu, hidroklórozása acetilén pirolízissel diklóretán. Termelés vinilidén-kloridot, a vinil-acetát és etilén.
Varnavskiy. 10 „B” alkalmazása alkének és alkodienov. Alkének. Etilén és homológjai könnyen oxidálódnak, például kálium-permarganatom: + O + H O és HO - CH azonban képződött etilén - viszkózus folyadék hasonló a glicerin előállítása során felhasznált a fagyálló, szintetikus szálak liter.
A földgáz egyike a mezők tartalmaz 92% metán, 4% etán. 1% propánt, 2% szén-dioxidot és 1% nitrogént (térfogat). Milyen az oxigén mennyisége égéshez szükséges 200 liter gázt?
Oxidatív kapcsolási alkinek és stádiuma. Szintézise acetoxylation etilén és egy olefin-oxid. Előállítása Az aldehidek és ketonok, hogy az alkoholok dehidrogénezésével fém és oxid katalizátorok. Az oxidációs reakció egy ipari szervetlen kémia.
Acetilén - színtelen gáz enyhe édeskés szagú. A tanulmány a termelési acetilén különböző módszerekkel: elektrokrekingom (metán), termikus krakkolás (a cseppfolyós propán), és termikus-oxidatív pirolízis származó metán a reakció gázok.
Telített szénhidrogéneket. Telítetlen szénhidrogének. Aromás vagy Arena Cikloalkánok Alkenes alkánok Diene Alkinek 1. Általános képlet CnH2n -metán
Fizikai és kémiai tulajdonságai a glikol. Folyamatábrája termelő etilén hidratálást okisietilena. Eljárás illóolajok. Az elv műszaki koprodukciója etilénglikol és okisietilena rögzített ágyas katalizátort.
Telített szénhidrogéneket. Telítetlen szénhidrogének. Aromás vagy Arena Cikloalkánok Alkenes alkánok Diene Alkinek 1. Általános képlet CnH2n -metán