Element V - hivatkozási vegyész 21
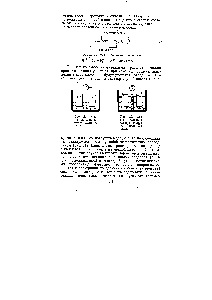
Történetileg, az első áramforrás kémiai elem volt, olasz fizikus Volta (1800). Az elem váltakozásából áll réz és cink lemezek elválasztva távtartók nemezből átitatott egy kénsav-oldattal. Gyűjtse eleme, ahelyett, hogy egy filc ruhát vagy szűrőpapíron. Számítani a maximális elektromotoros nyerhető egyetlen szakasz tagja. Akár fény jön a zseblámpa, ha csatlakoztatva van, hogy az elem írása a reakciók a katód és az anód. Magyarázd meg, miért miatt szétválasztása hidrogéngáz réz elektróda elem V van egy DC feszültséget. [C.354]

Úgy véljük, a lezajló folyamatok a sejtben kisülés közben voltot. [C.8]
A mai technikai fejlettségi szintje az üzemanyagcella, szorítkozunk itt a vita a tényleges elemekkel. Ugyanakkor ne feledjük, hogy a nyitás a Volta-sejt, amely szolgált a prototípus egy üzemanyagcella. ismert tanulmány vezetője akció elektromos áram lejtőn. Galvani 1791 feltételezték között szoros kapcsolat az elektromos jelenségek az elektromos sugarak, egyrészt, és felfedezték, hogy az állati elektromosság az izmok és az idegek - a másikon. Volta, másrészt azzal, hogy a Galvani nem mutatott egy állat. és fém elektromosságot. amely az ő véleménye, azt kaptuk, kapcsolati két eltérő fém. Ő bizonyára igaza van, hogy a békacomb, a történelmi tapasztalat Galvani szerepét játssza egy érzékeny detektor. de megtagadják állati elektromosság Volta volt a baj, bár ez egy téves következtetés, és vezette a létrehozását egy elektrokémiai cellában. néven galvanizáló. Számos eleme. Volta megkapta a nagyon pillére a Volta. amely alapját képezte a modern elemek, mint például az akkumulátorokat Bacon (lásd. ábra. 152), Allis-Chalmers cég (lásd. ábra. 162-165), valamint a Union Carbide cég (lásd. ábra. 4c 1496). [C.462]
Volta elem áll a réz és cink lemezek merítettük híg kénsav-oldattal. Miatt szétválasztása hidrogéngáz réz elektród (polarizációs cm. 8,5) volts elemnek nincs állandó feszültség. Ez volt a történelem első kémiai áramforrás. által létrehozott olasz fizikus Volta (1800) formájában váltakozó réz és cink lemezek, elválasztott csíkok érezte átitatott egy kénsav-oldattal. [C.218]
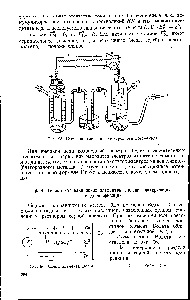
A gyártás a lemeztag Volta szükség amalgámozott cinket. Alaposan tisztítsa meg a felületet a cink lemez csiszolópapírral, vízzel öblítjük, majd alkohol és víz. Tedd a chip fürdőbe higany sóoldattal 5-10 percig (a higany-só, hogy végezzen egy speciális sütés). Vízzel és cink elektród szerelt egyik falát az akkumulátor csészét. A szemközti fali tisztítani rézlemez. Öntsük 1N üveg. kénsav oldat. Csatlakoztasson egy voltmérő egy kis áramfelvétel. Hogy míg Írja reakció egyenletek. zajlik az elektródákat. Miért cinklemezt amalgamiruetsya Mi elektromotoros erő az elem Milyen más akkumulátor cellákat használunk [c.81]
Bármilyen galvanikus tsyya egészében sosem 1) egyensúly. A visszafordíthatatlan elem általában lehetséges kémiai reakció, és nyitott a külső áramkör (reakció 2n + N2504 elem voltban). De reverzibilis (a fenti értelemben) a kör, mint egész messze termodinamikai egyensúly. Ha egy ilyen áramkör zárt, az utolsó ellenállás és így önmagát. A külső kör, az elektromos áram mérhető erő, azaz a. e. a lánc működik, visszafordíthatatlanul közeledik egyensúly. Szakadás csak átmenetileg szinte változatlan. Például, a nyitott cellás Daniel - Jacobi diffúzióval történik Cu2 + ionok át az oldaton, hogy a cink-elektróda érintkezik a cink elektród réz ionok egy visszafordíthatatlan (munka nélkül) ionok helyettesítési reakció SO2 + az oldatból cink fém, azaz, ugyanazt a reakciót, ami .. áramforrás ha dolgozik lementa. [C.519]
Miután a találmány az első elektrokémiai cella több mint ötven volts elem marad az egyetlen forrása a villamos áram a saját fejlesztés a következő főbb szakaszai a használata depolarizátor 1833, amely lehetővé tette a cellafeszültség sokkal stabilabb yym, egy 1836 g. Semleges elektrolit, növekedés karbantartott NOSTA forrásokból áram. g. fejlesztési 1865 sejtek egy szilárd depolyarizato sor, így növelve a hatékonyságát az elem. iso Bretenoux 1888 g. Száraz sejtek, és végül, az alkalmazás 1914 és, a depolarizátor a levegő oxigén. [C.13]
Egy példa egy irreverzibilis elem lehet egy eleme C 2n N2304 voltot. A közvetlen áramlását a folyamatot. t. e., olyan esetekben, amikor az elem biztosítja a jelenlegi reakció fordul elő [c.378]
Tegyünk Volta elem - az első a történelem, a cella. A réz és a cink nlasthshy (elektródák) merítünk 10% -os oldat -nyl Ng804. A lehetséges a réz elektróda nagyobb, mint a lehetséges cink. [C.167]
Kémiai áramforrások (1948) - [c.43]