Általános fogalmak és meghatározások
Ha a reakció közvetlen átalakulása útján a molekulák a kiindulási anyagok a reakciótermékben molekula, ez a reakció az úgynevezett egy egységet. A legtöbb kémiai reakciók nem elemi, hanem magukban foglalják több elemi kémiai konverziós lépésben.
A összessége elemi lépéseinek biztosító áramlás a kémiai konverziós nevű mechanizmussal egy komplex kémiai reakció.
Kémiai reakciók végbemehet, amely egy vagy több fázisú rendszerek.
Kémiai reakció belül előforduló egyik fázis homogénnek nevezzük. Reakció tér ebben az esetben egy folyékony vagy gáz-halmazállapotú rendszerek.
Kémiai reakciók határfelületén a két fázis az úgynevezett heterogén, és a reakciókamra egy felszíni felület.
Ez az útmutató az alapjait az elmélet a homogén kémiai reakciók zárt rendszerekben állandó térfogaton izoterm körülmények között.
A kémiai reakció sebessége
A kémiai reakció sebessége v az i -edik nevű anyag egy mennyisége megváltozik az anyag ni (mólban) egységnyi idő és egységnyi reakciótérbe V:
ahol V - mennyiség (reakciótérbe).
Ez a meghatározás a mértéke a komponens a legtöbb általános és érvényes minden komplex reakciók és bármely reagens bármilyen körülmények között.
Ha az a rendszer térfogata a reakció során nem változik, akkor lehetséges, hogy a differenciál jel, míg a
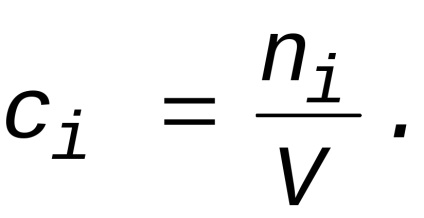
Ezután, ahelyett, hogy (1) megkapjuk
ahol ci - a koncentráció a figyelembe vett i-edik anyag egy adott időben. Így homogén kémiai folyamat, amely akkor fordul elő, állandó térfogaton sebességgel szerinti eljárás egy meghatározott anyagot az említett i -edik i-koncentráció változását az anyag egységnyi idő alatt. A dimenziója sebesség ebben az esetben egyenlő mol / (ls) vagy mól / (lmin).
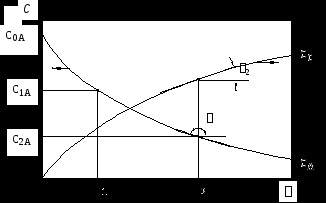
Annak vizsgálata során, a kinetikája kémiai reakciók egy zárt rendszer általában kísérletileg függését a komponenseinek koncentrációja (i -edik anyag) az idő függvényében, és azt mutatják, ez a kapcsolat, mint egy grafikon, ci = f (), amely az úgynevezett a kinetikus görbe (lásd. Ábra. 1 ).
Ha a rendszer kémiai reakció
ahol a, b, c, d - sztöchiometrikus együtthatók, koncentráció változását az egyik a kiindulási anyagok (például A) és az egyik termék (például, C) az idő lehet grafikailag ábrázolható a következőképpen:
kinetikai görbék
Megkülönböztetni az átlagos sebesség:
és a tényleges sebesség:
Kinetikai görbék érintők, érintők egyenlő szögek
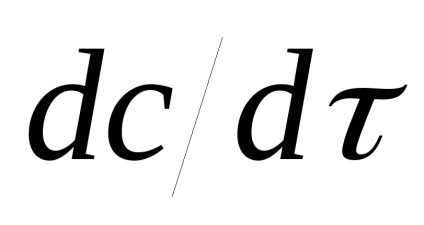
A reakció sebessége mindig pozitív. Azonban, amikor a reakció ideje csökkent koncentrációja a kiindulási anyagok és a reakciótermékek - növekvő (1. ábra). Ennek eredményeként, az arány a-származék
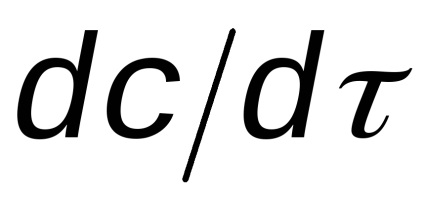
Általában a reakció sebessége átfolyik a (3) egyenletben lehet képviseli a következő kifejezés:
Például, a reakciót
Formálisan ez felírható
ahol -1, -1, és a 2 - sztöchiometriai együtthatók alá szabály jelek fenti (a kiindulási anyagok, sztöchiometrikus együtthatók kapott negatív). A reakció sebessége függ számos tényezőtől (az a koncentráció, nyomás, hőmérséklet, katalizátor, stb).
Az alapvető törvénye kémiai kinetika a tömeghatás törvénye (ZDM) szerelt Guldberg és Waage 1867 évben, kifejező függését a reakció sebessége a reaktánsok koncentrációja: állandó hőmérsékleten sebességgel egyoldalú kémiai reakció arányos a termék koncentrációjának, a reagensek megfelelő fokban.
Összhangban ZDM a reakció (3) lehet írni az egyenletet
koncentrációjának függését a reakció sebessége az úgynevezett a kinetikus egyenlet.
A arányossági tényező K egyenletben (9) van a sebességi állandó a kémiai folyamat. Fizikailag K a sebesség is, ha a koncentráció az egyes reagensek egyenlő egységét. A sebességi állandó függ összes tényezők, amelyek befolyásolják a reakció sebességét, kivéve a reagáló anyagok koncentrációit és az idő. A számértéke K is függ időzítés és a koncentráció egységek. A dimenziója ez határozza meg a kinetikai egyenlettel, amelyben éppen számoljuk, hogy van, attól függ, hogy az értékeket a kitevők a koncentrációk a reagensek.