Az atommag összetétele és jellemzői - stadopedia
A mag összetétele. Kísérletileg megállapítást nyert, hogy az atommag protonokból és neutronokból áll. Ezeket a részecskéket nukleonoknak nevezzük.
A proton (p) pozitív töltés és tömeg
ahol én vagyok az elektron tömege, амемм. Az atomi tömegegység. A protontömeget az energiaegységekben adják meg, amint az a nukleáris fizikában szokásos.
A proton spin s = 1/2 és egy belső mágneses pillanat
ahol m a nukleáris magneton (az egység, amelyben a nukleonok mágneses momentumait mértük):
A nukleáris magneton 1836-szor kisebb, mint a Bohr-magneton, vagyis a proton belső mágneses pillanata 660-szor kisebb, mint az elektron mágneses pillanata.
A neutron (n). Elektromos töltése nulla, és a tömeg közel van a proton tömegéhez:
amely 0,14% vagy 2,5 m több, mint a proton tömege.
A tömeg atomegysége megegyezik a semleges atom tömegével, 12 C, azaz 1 amu. = 1,66 · 10 -24 g vagy 931,50 MeV.
A neutron spin s = 1/2, és az elektromos töltés hiánya ellenére a neutron mágneses pillanata van
A mínusz jel azt jelenti, hogy a spin "iránya" és a neutron mágneses pillanata egymással ellentétes.
Szabad állapotban a neutron instabil és spontán bomlik, protonvá alakul és egy elektront és egy másik részecslőt bocsát ki, a neutrínó (v):
A felezési idő (az az idő, amely alatt a neutronok kezdeti számának fele bomlik) körülbelül 12 perc.
Az atommag jellemzői. Az atommagot jellemző fő mennyiségek a Z töltés és a szám A tömege. A Z-szám megegyezik a magban levő protonok számával és meghatározza a Ze elektromos töltését. Azt is nevezik atomszámnak. Az A tömegszáma meghatározza a magban lévő nukleonok számát. A magban lévő neutronok száma
Szimbolikusan a rendszermag ezen jellemzői a következők szerint jelennek meg:
ahol X jelentése az elemnek az adott maghoz tartozó elem kémiai szimbóluma, például H, U, U stb.
A magban lévő meghatározott számú protonok és neutronok specifikus atomjait rendszerint nuklidoknak nevezik. Az ugyanolyan számú protont (azaz egy kémiai elemhez tartozó) nuklidokat izotópoknak nevezik.
Az izotópok atomjai gyakorlatilag nagyon közel állnak a fizikai-kémiai tulajdonságokhoz. Ez annak köszönhető, hogy a mag az elektronhéj szerkezetét befolyásolja, főleg csak elektromos mezővel. Izotópokban ezek a mezők ugyanazok, kivéve néhány esetben. Leginkább ez a különbség a három nuklidban: H, H és H, amelyek magjai szintén szignifikánsan különböznek egymástól. Ezért a három nuklidnak különböző nevekhez vannak rendelve - ennek megfelelően a közönséges hidrogén, deutérium és trícium. és a deutérium és trícium magok a deuteron (d) és a triton (t).
Különböző atomok esetében az izotópok száma különböző, köztük stabil és radioaktív is.
A magok méretei. Az atommag (mint bármely kvantumrendszer) nem rendelkezik világosan meghatározott határral. Az elektronok és nukleonok atomokon történő szórásával kapcsolatos kísérletek során megállapítottuk, hogy minden magban van egy belső régió, amelyben a sűrűség # 961; a nukleáris anyag majdnem állandó, és
A felületi réteg, ahol ez a sűrűség nulla. A nucleonok koncentrációjának tipikus eloszlása a centrumtól való távolság függvényében
a rendszermag, vagyis az n (r) az 1. ábrán látható.
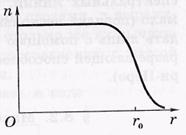
ahol r0 a mag sugara, a magtól a középponttól való távolság, ahol a nukleonok koncentrációja kétszeresére esik.
Az első megközelítésben a magot gömbsugárnak tekinthetjük
ahol 1 fm = 10-13 cm Ez a képlet fontos következtetést von maga után: a mag tömege, az A tömegszám határoz meg, arányos annak V. térfogatával.
A. Következésképpen az összes magban lévő anyag sűrűsége megközelítőleg azonos, és a számítás szerint egyenlő # 961; 2 × 1014 g / cm3.
A mag kötésének tömege és energiája
A mag tömege nem additív mennyiség: nem egyenlő a magot alkotó nukleonok tömegével. Ennek az az oka, hogy a magban a nukleonok erős kölcsönhatást fejtenek ki. Ennek a kölcsönhatásnak köszönhetően, hogy a sejtmag teljes elválasztása külön szabad nukleonokká alakuljon, minimális munkát kell elvégezni, amely meghatározza az Ec mag kötési energiáját. Ezzel szemben, ha egy magot szabad nukleonokból alakítanak ki, ez az energia szabadul fel (például elektromágneses sugárzás formájában).
A számítások egyszerűsítése érdekében a tömeghiba fogalmát a mag vagy a nukleon tömege (amu) és tömege (A) tömege (m-A) különbözteti meg.
ahol N = A-Z. Ennek megfelelően a táblázatok nem mutatják a nuklidok tömegét, hanem tömeghibákat.
Különleges kötési energia. Ez az úgynevezett kötési energia, amely átlagosan egy nukleon, i.e. Eq / A. Ez a mennyiség jellemzi a mag magasságának mérését: minél nagyobb az Ec / A érték. annál erősebb a mag.
Az atomokban lévő elektronok kötési energiája 10 eV sorrendben van, ami elhanyagolható a mag kötési energiájának nagyságával.
Az Ec / A specifikus kötési energia függ az A. tömegtörtől. A függő függvény grafikonját az ábrán mutatjuk be.
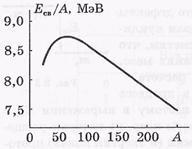
A magok specifikus kötési energiája szinte független
az A tömegszám és körülbelül 8 MeV. Az A-re specifikus kötési energia hozzávetőleges nem függése azt jelenti, hogy a nukleáris erőknek telítettségük van. Ez abban áll, hogy minden egyes nukleon csak korlátozott számú szomszédos nukleonnal kölcsönhatásba lép.
Ebből is következik, hogy a nukleáris erők rövidhullámúak, és a magban lévő nukleonok közötti átlagos távolság rendje (
A legstabilabbak az A tömegszámú magok
50 ÷ 60, vagyis a Cr-Zn elemei.