Antitestek - a humorális immunitás effektor molekulái
Az adaptív humorális immunválasz fő effektormolekula immunglobulin molekulák.
Az immunglobulinok főbb osztályainak szerkezete és funkciója
Az immunglobulinok szerkezete R. Porter és G. Edelman műveinek köszönhetően vált ismertté. R. Porter a nyúl IgG készítményt papain enzimmel kezelte. Ennek eredményeképpen három fragmenst kaptunk, amelyek közül kettő azonos molekulatömeggel (45 kDa) volt, és az antigént kötötte. Fahl-nak hívták őket. A harmadik (55 kDa), állandó szerkezetű fragmentum képes volt könnyen kristályosodni, és Pc (Eng. Fratell cinquilary). A pepszin hatására az immunglobulin molekula máshol két fragmentum keletkezik: a Pc fragmens és a fragmens (Pab) 2, amely két antigénmolekulát képes kötni.
G. Edelman az antitest molekuláknak a merkapto-etanollal történő feldolgozása után, a diszulfidkötések helyreállítása miatt ezeknek a molekuláknak az elkülönítése különálló fehérje láncokká alakult. E vizsgálatok alapján az immunglobulinok szerkezetének bázikus sémáját javasolták (4-1. Ábra).
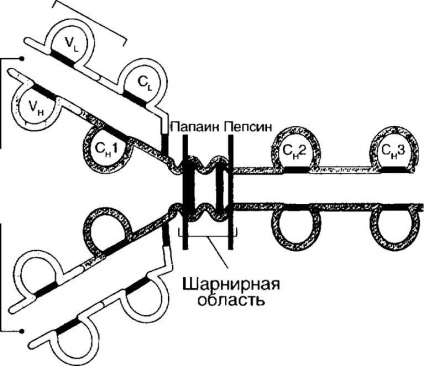
Emberben az immunglobulinok öt osztályát különböztetjük meg: IgM, IgG, IA, 1% 0 és IgE. A különböző osztályok immunglobulinjai hasonló szerkezeti tervvel rendelkeznek. Az immunglobulinok szerkezetét az 1. ábrán mutatjuk be. 4-1.
immunglobulin molekula négy polipeptidláncból: két nehéz (H - kealu) láncok molekulatömege 100-120 kDa, és két könnyű (L - IF1) láncok molekulatömege 50-60 kDa. Ezeket a láncokat kovalens kötésközi diszulfidkötéseknek (-3-3-) okozzák. Minden lánc tartalmaz egy variábilis (Ui Un - Yanagimachi) domének, amelyek meghatározzák a specificitás a molekula-immunoglobu lin és konstans (C - ^ ap ^ sop5) domének. A b-láncnak van egy állandó része (C, -domain). A H-lánc három konstans domént tartalmaz: CH1, CH2, CH3. A CH1 és CH2 között egy csuklórégió van, amely homológ régiókból áll, amelyek körülbelül 110 aminosavmaradékot tartalmaznak. A szénhidrát-komponens kapcsolódik egy nagyobb mértékben, hogy a CH2-domén és egy sor biológiai tulajdonságainak immuno-molekulák noglobulinov (betartása Fc-receptorok lektinek). A domén fő elemei két párhuzamosan párhuzamos p-fold réteg, amelyek egy vagy több diszulfidkötéssel kapcsolódnak. Ez a szerkezet az immunglobulin domén megjelent korai evolúció és vált szerkezeti elem a különböző receptorok a kombinált immunoglobulin szupercsalád (TSC, MHC-molekulák, molekulák adge-Sion, Fc-receptorokat, és mások.).
Amikor egy immunglobulin molekulát antigénként vizsgálunk, a következő antigén determinánsokat lehet megkülönböztetni:
* az izotípusok olyan meghatározó tényezők, amelyek meghatározzák a nehéz láncok állandó régióinak szerkezeti jellemzőit (az izotípust a nehéz láncok típusai határozzák meg). Az izotípusok megegyeznek a faj valamennyi egyedével;
* allotípusok - az egyes izotípuson belül az immunglobulinok egyéni allélikus variánsai, amelyeket az állandó domének vagy az U-domének keretrégiói variábilitás okoz;
* idiotípusok - antigén determinánsok, amelyek variábilis doménekben lokalizálódnak, amelyek meghatározzák az antitest molekula specifitását.
Az antigénkötő hely mindkét immunglobulinlánc N-terminális doménjein helyezkedik el. Vb és V doménekből áll, és egyedi specifitással rendelkezik. A változó tartományokon belül az SOK hipervariábilis régiói különböznek: SBK1, SBK2, SEZ. Ezek a szekvenciák kölcsönhatásba lépnek az antigénnel. Az immunglobulinok különböző antigéneket kötnek össze: olyan peptideket, poliszacharidokat, szteroidmolekulákat és természetes antigéneket, amelyek nem végeztek előzetes kezelést. A monomer immunglobulin molekulájában két aktív központ kapcsolódik az anti-génekhez.
Az egyik epitóp és az immunglobulin egy aktív helyének kötési erejét afinitásnak nevezzük. Az antigén és az ellenanyag között számos nem kovalens kötés keletkezik: hidrogénkötések, hidrofób kötések, elektrosztatikus kölcsönhatások, van der Waals-erők. Az egész antitestmolekula és az összes antigén epitóp közötti interakció teljes erejét aviditásnak nevezzük. Az immunglobulin molekula konzervatív helyei (úgynevezett keretek) Y-régiói kötődhetnek a fémionok, a szuperantigének és enzimatikus aktivitással rendelkeznek.
Immunglobulinok léteznek a szervezetben:
* oldható formában a vérben és más testnedvekben;
* az immun komplexek részeként (antigén-antitest);
* a VSK felépítésében;
* a sejtek felületén (makrofágok, neutrofilek stb.) a Pc-receptorokra rögzítve.
A különböző osztályokba tartozó immunglobulinok fő jellemzőit a táblázat tartalmazza. 4-1.
1§M. A Molecule IgM nagy molekulasúlya 970 kDa, ezért gyengén behatol a szövetekbe. Az IgM öt monomerből áll, amelyek egyetlen pentamer molekulában diszulfidkötésekkel és lánccal egyesülnek (4-2. Ábra). Az u-lánc szerkezete négy C-domént tartalmaz.
A pentamer mellett az 1M monomer formában létezik a B-limfociták membránján a VSC összetételében (lásd a 3-20. Ábrát).
Az immunválasz során először az első IgM antitesteket állítják elő (lásd a 4-5. Ábrát). Az IgM az antigénnel való érintkezés után konformációs változásokon megy keresztül, és ezután megszerzi a legnagyobb képességet a komplementrendszer fehérjéinek megkötésére és aktiválására.
Az 1M fő fiziológiai funkciója a kórokozók (főleg vírusok) semlegesítése a véráramban.
1C. Ennek az izotípusnak az immunglobulinjai az antitestek többségét alkotják másodlagos immunválaszsal. Az IgC szabadon behatol a szövetekbe, és ez is az egyetlen immunglobulin, amely átjut a placenta gáton. A méhlepényen keresztüli szállítás nem passzív, és az újszülött Pc-receptor (PcKn) részvételével történik az IgG esetében. A jellemző PcKn a 3.1. Szakaszban található. A PcKn fő funkciója, hogy megvédje az IgG-t a katabolizmustól az internalizáció után. Ez a mechanizmus biztosítja az IgG transzportját az epitélium és az endotélium gátjai révén, amelyek az IgG transzplantációját érintik az anyáról a magzatra. Az IgC négy alosztálya: 1C1, 1C2, 1 # C3, 1C4; tulajdonságaik különbségeit
Ezek a táblázatban vannak felsorolva. 4-1.1GCI és 1GCC aktiválja a komplementet, a fagocitákat és a gyilkos sejteket. Az LgC2 és az lgCl4 a kórokozók közvetlen semlegesítésében vesznek részt.
CA A log A két alosztálya van. 1 ^ A1 kering a vérben és segíti a véráramba csapódott kórokozók semlegesítését. Az 1A1 azonban érzékeny a bakteriális proteázok hatására, ezért elengedhetetlen szerepet játszik a kórokozók semlegesítésében. Az IgA2 lokalizálódik a nyálkahártyák titkaiban, és részt vesz a kórokozók semlegesítésében, amelyek így áthatolnak a testben. Az 1A dimereket a nyálkahártyák nem-kapszulázott limfoid szövetének plazmasejtjei szekretálják, például a bél Lamma proropájában. Ezután kötődnek a poliimunoglobulin receptorhoz az epitheliális sejtek bazolaterális felületén, és ezeket az sejteket endocitózissal abszorbeálják. Egy különleges vezikulumban ezt a komplexet a ketrecben szállítják és a nyálkahártyában ürülnek ki. A szekréciós komponens védi az 1A molekulát proteolitikus enzimek hatásától (4-3. Ábra).
Az IgA részt vesz a nyálkahártyák első védelmi vonalának kialakulásában. Nem aktiválja a komplementet, nem rendelkezik baktericid hatással.
A titerek 1dA szerkezete
de fontos szerepet játszik a bakteriális toxinok semlegesítésében. Az IgA a kolosztrumban található, és az újszülöttek immunvédelmét biztosítja a nyálkahártyák szintjén.
Ig0 transzmembrán B-limfocita receptor, funkciói nem ismertek.
18E kötődik a bazofilekhez, a hízósejteket a PseC1-en át, és a nyálkahártyák sejtjeinek szenzibilizációját idézi elő, ami allergiás reakciók kialakulásához vezet.
A magzat és az újszülött csecsemők az anyától származnak, és 6-8 hónap elteltével eltűnnek a csecsemő vérszérumából. Ebben az időben a gyermek immunrendszere megkezdi az IgM és IgA szintetizálását. 1 éves korban a gyermek vérében a saját 1M szintje gyakorlatilag eléri a felnőttek szintjét, 1C - 75%, IgA - 25% (4-4. Ábra).
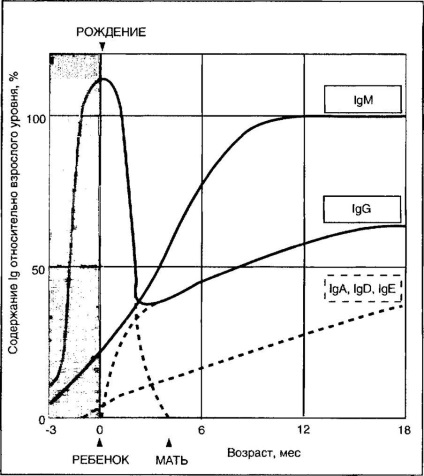
Ábra. 4-4. A humán szérum immunglobulinok tartalmának korával való változása (Hobbs IL 1969 adatai alapján).
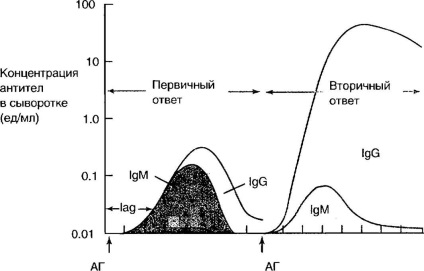
Az 1. ábrán. A 4-5. Ábra az antigén kezdeti és ismételt beadása során különböző osztályú immunglobulinok termelésének dinamikáját mutatja. Az elsődleges immunválaszon az antitestek többségét 1M jelöli. Az antigén ismételt bevétele a szervezetbe, az IgM mennyisége nem változik, az immunglobulinok domináns csoportja IgG-ből származik. Az antitestek affinitása ebben az esetben jelentősen növekszik, gyorsabban jelenik meg, és nagy koncentrációkat ér el, hosszabb ideig fennmarad.
Az antitestek által közvetített kórokozók elleni védekező mechanizmusok a molekulák különböző funkcióinak köszönhetően megvalósíthatók.
• Az antitestek antigénspecifikus funkciója. Ennek eredményeként a tömörítő egy kórokozó-TION az aktív központ az antitest-CIÓ történik semlegesítése a kórokozók és nehéz behatolni a sejtek a szervezetben. Ez elsősorban az 1M-re vonatkozik, amely a diftéria és tetanusz toxinjainak kötődésében és semlegesítésében, valamint számos vírusban szerepet játszik. A semlegesítés után a kórokozók elveszítik a célsejtekhez való kötődés képességét, eltávolítják a véráramból és elpusztítják a makrofágok. 1§A dimerek kötődnek az antigéneket a lumen a szervek és megakadályozzák a behatolást a kórokozók epite-ly nyálkahártyákat.
Immunizálás után
Ábra. 4-5. Az immunglobulin termelés dinamikája primer és másodlagos immunizálásban.
Az antitestek opsonizálhatják a baktériumokat és a különböző célsejteket, így hozzáférhetőbbek a fagocitózis vagy antitestfüggő sejtes citotoxicitás szempontjából.
A által közvetített effektor funkciókat az antitest Fc-molekularész, amely kölcsönhatásba lép a Fc-receptorok a veleszületett immunrendszer-theta sejtek vagy komplement (ábra. 4-6). Ezek között megkülönböztetik a következő funkciókat.
A komplement aktiválása a klasszikus típusú és komplement által közvetített lízis célsejtek (ábra. 4-6, a), a 1§M, 1§SZ, 1C1 kombinálva egy antigénnel kölcsönhatásba valaki nents kiegészítik S4 és SZ-rokon vörösvértestek. Így, a vörös vérsejtek hozza immunkomplexek a májban és a lépben, ahol fagocitálódnak és megsemmisítik makro-fágok.
Kötés a komplex „antigén-antitest” makrofágok és neutrofilek filami expresszáló CSF receptorok ezt követő eszköz-TION fagocitózis és megsemmisítése a komplex (lásd. Ábra. 4-6). Antitestfüggő sejtes citotoxicitás (AZKTS). NK-sejtek, eozinofil, neutrofil és egyéb sejtek expresszálják ruyut RsuK III típusú (SB16). Ezek a receptorok kötődnek az IgG molekulákon keresztül kötődő effektor sejtekhez a fertőzött célsejtekhez. NK sejtek kiváltó perforingranzimovy citotoxicitásának mechanizmusa és célsejtek elpusztítására, apoptózis előidézésére ki (ábra. 4-6, C).
- A sejtek aktiválása az antitestek membrán receptorainak kölcsönhatása során (4-6. Ábra, d).
IgE által közvetített túlérzékenységi reakció. Kötődése az antigén komplex (allergén) ellenanyag-1E keresztül nagy affinitású receptorok RseK1 hízósejtek és bazofil sejtek ini kényszeríti a degranuláció ezen sejtek és a vazoaktív mediátorok (hisztamin, L eykotrieny B4, prosztaglandinok) (ábra. 4-7). Ez vezet a fejlődés a vascularis reakciók, értágulat, növelve ezek permeabilitását, az ödéma hozzájárul az antigén és a késedelem a tűzhely, megakadályozza, hogy behatoljon a vér. Ezenkívül a simaizmok intenzív csökkentése, a hörgők és az emésztőrendszeri görcsök csökkentése.
Binding 1§E indukált eozinofil sejtek alacsony affinitású RseKN-tsiruet oktatás eozinofilek fehérje-toxinokat, hogy megölik a bélférgek 1§E fejlődő antitest-közvetített citotoxicitást ragasztó-pontos.
Ezenkívül az antitestek bizonyos esetekben képesek az antigént, azaz E. a peptidáz és a DNáz enzimatikus aktivitása van. Ismeretes, hogy az autoantitestek elégtelen betegeknél
Az antitestek hatásmechanizmusként közvetítő molekulaként működnek
1 Immun 2 Immun 3 Célsejt / 4 Antigén
komplex komplex / patogén patogén