Sejtbiológia
Ingyenes és kipróbált riboszómák: fehérjék lenyelése EPS-ben
"Szabad" és "kíméletes" riboszómák Edit
A közlekedés továbbítása az EPR-ben Szerkesztés
Transzport fehérjék szállított EPR, mint a szintézis, a riboszóma szintetizáló fehérjék szignál szekvenciát a EPR, „ül” a specifikus komplexek a membrán transzlokációs EPR.
Az EPR szignálszekvenciája tipikusan 5-10 főleg hidrofób aminosavat tartalmaz és a fehérje N-terminálisán helyezkedik el. A távoli végén egy konszenzus szekvencia van felismerve egy specifikus proteázon. Ezt a jelszekvenciát egy speciális komplex - "jelfelismerő részecske" (SRP) azonosítja. Az SRP hat fehérjéből és egy rövid RNS molekulából áll.
Egy SRP hely kötődik a szignálszekvenciához, a másik pedig a riboszómához kapcsolódik, és blokkolja a fordítást. Egy különálló SRP domén felelős az EPR membránon lévő SRP receptorhoz való kötődésért.
Az SRP-vel együtt a riboszóma EPR-re mozog, és az EPR membrán citoszolikus oldalához kötődik az SRP receptorhoz (integrál fehérje). Ez a komplex (riboszóma - SRP-SRP receptor) néha egy protein transzlokátorhoz kötődik az EPR membránon. Jellemzően több riboszómát kapcsolnak az mRNS-hez, és a poliribozomok az EPR membránon helyezkednek el, és minden egyes riboszóma a pórusához kapcsolódik. Elérése a 3'-végén az mRNS, riboszóma visszatér a citoplazmában, mRNS de megmarad a membrán ESR annak a ténynek köszönhető, hogy az új riboszóma kötött SRP, csatolt az 5'-végén.
Kötődés után a komplex SRP transzlokátor - SRP receptor elválasztjuk a riboszóma, és ez vezet a újrakezdését sugárzott. Ma már bizonyított, hogy a fehérje-transzlációt, mint EPR áthatol a víz csatornán transzlokátort amelynek kapumechanizmusa eukariótákban, és kialakított négy alegységből komplex Sec61 (homológ fehérjék a baktérium sejt membránok).
A fordítás folytatását követően a szignálszekvencia hidrofób része továbbra is kapcsolódik a transzlokátorhoz, és az újonnan előállított szintetizált fehérjét hurkolták be az EPR-be. Ez a folyamat nem igényel ATP energia további kiadásait. Miután a fehérje C-terminusa elválik a riboszómától, és az EPR belsejében található, a szignálpeptid proteázza leválasztja a fehérjét. Fehérje az ESR minimalizálható megszerzésével normál konformációt, míg a jel peptid egy oldalcsatornás megnyitott transzlokátor mozgatjuk a lipid kettős rétegű membránhoz EPR, ahol proteázok gyorsan elpusztítják.
Fogott az EPR egy fehérje a organellum, ha van egy speciális „tartja a EPR» (ER-visszatartó) szekvencia négy aminosav a C-terminálisán. Néhány a fennmaradó EPR fehérjék fontos szerepet játszanak a hajtogató és a poszt-transzlációs módosítást fehérjék áthaladó EPR. Így az enzim diszulfid izomeráz katalizálja az szabad SH-csoportok a cisztein és a diszulfid-kötések a fehérje-chaperone BiP megakadályozza misfoldingot és aggregációját fehérjék alkotnak egy kvaterner struktúrák, valamint elősegíti a megtartását rokon proteineket ESR.
Fehérjék beágyazása EPR membránokba
Hasonló, de összetettebb mechanizmus biztosítja a transzmembrán fehérjék kotranszlációs integrálását az EPR membránba.
Post-translational transzport az EPR Edit-ben
Van is egy transzport protein posttranlyatsionny a EPR (gyakoribb élesztő), ahol a teljesen szintetizált fehérje kötődik a chaperonok a citoszolban, majd átvisszük EPR keresztül transzlokátor bevonásával Hsp70 család chaperonok. Ez a fajta közlekedés olyan ATP-függő. A szállításhoz peptidek (hossza előnyösen 8-16 aminosav) a citoszolból a EPR későbbi bemutató komplexet az MHC-I-molekulák egy speciális transzlokátor - TAP-fehérjét.
A fehérjék szállítása az EPS-ből a Golgi-készülékhez Edit
A fehérjék az AH-ból származó EPR-ből jönnek a határolt membránhólyagok belsejében, amelyek membránja a COP-II fehérjéből képződik. Minden helyesen összehajtott fehérje alapértelmezés szerint ilyen buborékokba kerül, és áttér az AG-re, majd néhányuk visszatér az EPR-hez. Azonban a speciális jelzőcímkékkel rendelkező fehérjék koncentrálódnak a szállítóhólyagokba, és az ilyen címkék nélküli fehérjék kis mennyiségben jutnak el hozzájuk. Az EPR buborékoktól elkülönítve, a kagylók elvesztése után, csomó-vesikuláris klaszterekbe merülnek fel, amelyek a motorfehérjék segítségével a mikrotubulusok mentén mozognak az AH-hoz. Ezektől a klaszterektől (valamint a cisz-Golgi-tól) a COP-I fehérjével övezett vezikulumokat elválasztják, amelyek biztosítják a rezidens fehérjék EPR-hez való visszatérő transzportját. Vissza fehérjék EPR van ellátva egy rövid szignál szekvenciát a C-terminális, amely kötődik közvetlenül COP-I (a membrán fehérjék), vagy egy adott receptorhoz, amely kölcsönhatásba lép a COP-I (az oldható fehérjék). Az ilyen szekvenciától megfosztott fehérjék túlnyomórészt az AH-ban maradnak.
A hólyagok belsejében a fehérjék fokozatosan mozognak a cisz-Golgi-tól a transz-Golgi-ig. Ahogy a fehérjék az AG-n belül mozognak, a glikozil-transzferáz enzimek módosítják oligoszacharid "címkéiket". Hasonló enzimek segítségével a glikoproteinek - mucinok és proteoglikánok szintézise - az AH-ban megy végbe.
A Golgi készülék fő funkciója a fehérjék válogatása
A fehérjék lizoszómák szállítása
A fehérjék szállítása az AH-tól a lizoszómákig
A membránfehérjék lizoszómák és az emésztő enzimek jönnek a transz-Golgi tagjai határolt clathrin buborékok a korai endoszóma, és onnan - a lizoszóma. Ahhoz, hogy írja be a lizoszomális enzimek (savas hidrolázok) a lizoszómákban kellene prisutsvovvat speciális jel - maradékok mannóz-6-foszfát-végei az oligoszacharid láncok. Ez a címke a két szakaszban történik. Először is, a cisz-Golgi enzim N-atsetilglyukozaminfosfotransferaza tulajdonít oligoszacharidok maradékok N-atsetilglyukozaminfosfata, majd a transz-Golgi második enzim elhasítja az N-acetil-glükózamin. A címke esetében alkalmazzuk, amelyek a fehérjéket, amelyeknek a sajátos jellemzőit harmadlagos szerkezet - „jel bump» (jel tapasz). Ezután, mannóz-6-foszfát-azonosítjuk specifikus membrán receptor csatlakozott egy hidroláz. Az oldat pH-endoszómák csökkentjük hidroláz elválasztjuk receptorokból speciális buborékok szállítják vissza, és a magas vérnyomás.
Mutációi a gén N-atsetilglyukozaminfosfotransferazy eredményeként súlyos mucopolysaccharidosis - I-sejt betegség, ahol az összes lizoszomális enzimek kiválasztódik az extracelluláris közegbe.
A fehérjék szállítása a környezetből lizoszómákká
Még a norma szerint a lizoszomális enzimek egy része felszabadul a sejtből, és a lizoszómák néhány membránfehérje belép a külső membránjába. Az extracelluláris környezetből a lizoszómális enzimek endocitózissal felszívódhatnak és lizoszómákká alakíthatók át (lásd [2]).
A fehérjék szállítása a citoplazmától a lizoszómákig
Az AH-tól történő hólyagos transzport mellett a fehérjék másik módja a lizoszómáknak. Így a chaperon által közvetített autofágia esetében a részlegesen denaturált fehérjék irányított transzportja van a citoplazmától a lizoszóma membránon keresztül az üregébe, ahol emésztést végzünk. Ez a típusú autofágia, amelyet kizárólag emlősök számára írtak le, stresszt okoz. Ez akkor fordul elő részvételével citoplazmatikus chaperon proteinek HSP-70 család, kiegészítő fehérjék és a LAMP-2, amely egy membrán receptor komplex, és a chaperon fehérjét, hogy a közlekedés a lizoszőmában. Az antigén-prezentáló sejtek (például dendritikus sejtek) peptid szállítási prezentiruemyh komplexált MHC-II, előfordulhat közvetlenül a lizoszóma keresztül-transzlokátor fehérje TAPL.
A fehérjék szállítása a sejtmaghoz és a magból
A fehérjék bejutnak a magba a nukleáris pórusokon keresztül. A nukleáris idő alatt legfeljebb 500 makromolekulát lehet szállítani egyszerre mindkét irányban. A molekulasúlytól 5 000 daltonig terjedő fehérjék (peptidek) szabadon diffundálnak a nukleáris pórusokon keresztül (így koncentrációjuk a citoplazmában és a magban egyaránt). A pórusokon keresztüli passzív átvitel (diffúzió) behatolhat 60 000 dalton molekulatömegű fehérjékbe.
A nagyobb fehérjék a sejtmagba, amelyek között csak a szignál szekvencia a mag (egy vagy két rövid része a fehérjének, gazdag pozitív töltésű aminosavak - arginin vagy lizin). kötődnek specifikus fehérjék az ezzel a szekvenciával - receptorok importálja a sejtmagba (néha további adapter fehérjék). Import receptorok a sejtmagba, és kötődik a komponenseket az erőteljes hosszú. Ez biztosítja az energia közlekedési GTP hidrolízis végzett kis monomer GTP alapjai - Ran-fehérjéket. A citoplazma Ran-fehérje kötve van GDP formában, mind a citoplazmában lokalizált Ran-GAP proteinek (fehérjék aktivátorokat GTPáz aktivitását Ran), és a sejtmagban Ran-fehérje kötve van GTP formában, mint a mag lokalizált fehérje, amely cserébe a GDP GTP. Ran-GTP-kötő a belsejében a pórusok egy erőteljes „betöltve” import receptort a sejtmagba, biztosítja azok behatolását a sejtmagba és kirakodás. Ezután, a mellékelt receptor Ran-GTP kilép a citoplazmába, ahol fehérje GAP-GTP okoz hidrolízis és elválasztás Ran-GDP import receptor a sejtmagban.
Hasonló mechanizmus biztosítja a fehérjéknek a magból történő kivitelt, csak ezeknek a fehérjéknek különböző szignálszekvenciákkal kell rendelkezniük, amelyek kötődnek a sejtmagból származó export receptorokhoz (szerkezetekhez hasonló fehérjék az importreceptorokhoz).
Ezt a kérdést részletesebben a Nukleáris Pórus szakaszban tárgyaljuk
Fehérjék szállítása a Golgi készülékről a külső membránra
Az EPS-membránba ágyazott fehérjék, amelyek az AH hólyagjai részeként jönnek a sejt külső membránjára. A membránhoz vezető irányuk a hólyagok és a cytoskeleton mikrotubulusai közötti kölcsönhatásnak köszönhető, valamint olyan speciális dokkolófehérjéknek köszönhetően, amelyek biztosítják a hólyagok membránon való fúzióját.
A Golgi készülék Edit szekréciós funkciója
Endocitózis: fagocitózis és pinocitózis
[1] - A pinocitózis animációja (a koleszterin LDL-sejtben történő felszívódásának példáján) (angol szöveg)
Exocytosis és transzcitózis Edit
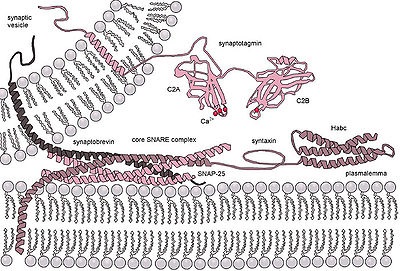
A neurotranszmitter exocitotikus felszabadulásának molekuláris gépe a szinapszisban. A SNARE komplexet a szinaptobrevin négyszálú kapcsolása képezi. szintaxis és SNAP-25. A Synaptotagmin kalciumszenzorként és egy fehérje komplex kialakulásának belső szabályozójaként szolgál
Az egzocitózis mind eukariótákban, mind prokariótákban fordul elő. Exocitózis (a görög Έξω -. Külső és κύτος - cella) eukariótákban - celluláris folyamat, amelyben az intracelluláris vezikulák (vezikulák) egyesül a külső sejtmembránban. Exocitózis esetén a szekréciós vezikulumok (egzocitózisos hólyagok) tartalma kívülről szabadul fel, membránjaik pedig a sejtmembránnal. Gyakorlatilag minden makromolekuláris vegyületet (fehérjéket, peptid hormonokat stb.) Eukarióta sejtekből izolálnak így.
A prokariótákban hólyagos exocitózis mechanizmus nem találtak, ezek az úgynevezett exocitózis beágyazást fehérjék a sejtmembránban (vagy a külső membrán a Gram-negatív baktériumok), fehérjék elválasztását a sejtekből a környezetbe, vagy a periplazmatikus térbe [1].
Az egzocitózis különböző feladatokat hajthat végre:
- a sejtnövekedéshez szükséges lipidek sejtmembránnal történő bejuttatása;
- Szállítás a membránfehérjék membránjához. mint például receptorok vagy transzportfehérjék. Ugyanakkor a fehérje azon része, amely a szekréciós vezikulumba irányult, úgy tűnik, hogy a sejt külső felületén kiállóan jelenik meg;
- különböző anyagok izolálása a sejtből; ez lehet például, emésztetlen étel fagotrofnyh egysejtűek, emésztő enzimek állatokban cavitary emésztést, fehérjék sejtközötti állatokban és sejtfal anyag a növényekben, jelátviteli molekulákra (hormonok vagy neurotranszmitterek).
Az eukariótákban kétféle exocitózis létezik:
- Kálcium-független konstitutív egzocitózis szinte minden eukarióta sejtben fordul elő. Ez egy szükséges eljárás extracelluláris mátrix létrehozására és fehérjéknek a külső sejtmembránhoz történő eljuttatására. Ebben az esetben a szekréciós vezikulumokat a sejt felületére juttatjuk, és a külső membránnal együtt biztosítjuk.
- A kalciumfüggő alkotmányos exocitózis például a kémiai w: szinapszisokban vagy makromolekuláris hormonokat termelő sejtekben fordul elő, és például a neurotranszmitterek izolálására szolgál. Az ilyen típusú egzocitózisban a sejtben felszabadulnak a szekréciós hólyagok, és a felszabadulásuk folyamatát egy bizonyos jel váltja ki, amely a kalciumionok koncentrációjának gyors növekedése a sejt citoszoljában. A preszinaptikus membránokban az eljárást egy speciális kalciumfüggő fehérje komplex végzi [w: [SNARE |]].
Intracelluláris emésztés Edit
Az intracelluláris emésztés mechanizmusa Edit href = Edit
Az intracelluláris emésztés szerepe az állatoknak Edit href = Edit
Autophagy, szerepe Szerkesztés
Az autofágia (az ókori görög αὐτός -. Önmagában és φαγεῖν - «a»), «samopozhiranie” - a folyamat, amelynek során a celluláris komponensek szállítják bele, és megy lizoszómális lebontásának bennük.
Most háromféle autofágia különböztethető meg: mikroautofági, macroautophagy és chaperon-függő autofágia.
Amikor mikroautofagii mint a kialakulását multivezikuláris szervek kialakított membrán betüremkedése endoszómák, illetve lizoszómák amelyeket azután elválasztjuk formájában belső vezikulumok, csak esnek anyagok szintetizált magát a sejtet. Ily módon a sejt megemésztheti a fehérjéket, ha nincs energia vagy építőanyag (például éheztetés közben). De a mikroautofágia folyamata normál körülmények között zajlik le, és általában nem szelektív. Néha az organoidok a mikroautofág alatt emészthetők; így élesztőben leírt mikroautofagiya peroxiszómákra és részleges mikroautofagiya magok, amelyekben a sejtek életképesek maradnak.
Amikor macroautophagy citoplazmatikus régió (gyakran tartalmaz semmilyen organellumok) körülvevő membrán fülkék, mint endoplazmatikus retikulum tartályban. Ennek eredményeként ezt a régiót a citoplazma többi részéből két membrán választja el. Az eltávolított szerves sejteket és a citoplazmát körülvevő ilyen két membránszerveket autofágómának nevezik. Az autofágómák kombinálódnak a lizoszómákkal. formáló autofagolizomokat, amelyekben a szerves sejteket és az autofagoszómák többi részét emésztjük.
Nyilvánvaló, hogy a makroautókezelés is válogatás nélküli, bár gyakran hangsúlyozta, hogy segítségével a sejt megszabadulhat a "szervektől, amelyek szolgálati idejüket" (mitokondriumok, riboszómák stb.).
A harmadik típusú autophagy chaperon közvetítés. Ezzel a módszerrel részlegesen denaturált fehérjéknek a citoplazmából a lizoszómamembránon keresztül történő irányított transzportja van az üregébe, ahol megemésztik őket. Ez a típusú autofágia, amelyet kizárólag emlősök számára írtak le, stresszt okoz. Ez a hsc-70, a segéd fehérjék és a LAMP-2 citoplazmatikus fehérje-chaperonjainak részvételével fordul elő. amely a chaperon komplex membrán receptoraként és a lizoszómába szállítandó proteinként szolgál.
A sejthalál autofág típusú típusában minden sejtszervezet emésztésre kerül, így csak sejtréteget hagy. a makrofágok felszívódnak.