Aktivációs energia
A reakciók a molekulák közvetlen ütközésének következményei. Azonban nem minden ütközés kémiai kölcsönhatáshoz vezet. Az új anyagok képződését csak olyan molekulák segítik elő, amelyek elegendő energiával rendelkeznek. Az ilyen molekulákat aktív molekuláknak nevezik.
Ezt a kémiai reakció megkezdéséhez elegendő minimális energiát aktivációs energianak nevezik, és kcal-ban vagy kJ-ban kifejezve. Minél alacsonyabb az aktiválási energia, annál gyorsabb a reakció.
Azokban a reakciókban, ahol az aktiválási energia nagyobb, mint 150 kJ, t = 25 ° C, az arány nagyon alacsony vagy gyakorlatilag ilyen reakciók nem fordulnak elő. Olyan reakciókban, ahol az aktiválási energia kisebb, mint 60 kJ, a sebesség nagyon magas (robbanás).
Az Ea aktivációs energia értéke a reagáló elemek jellegétől függ és az egyes reakciók jellemzőjeként szolgál.
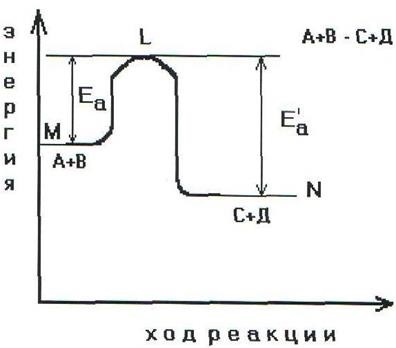
A reakcióképes energia diagramja a képződéssel
Annak érdekében, hogy az A és B reakcióvegyületek C és D reakciótermékeket képezzenek, le kell küzdeniük az ML védelmi gátat. Ez kihasználja az Ea aktiválási energiát. Ebben a reakcióban a közbülső instabil csoportosítás - az aktivált komplex (2.6. Ábra) a megvalósító anyagok részecskéiből képződik.
Ez a komplexum felbomlik a végtermékek kialakulásával, és ez az energia mennyisége szabadul fel, ami lehetővé teszi a végtermékeknek a végtermékek átlagos energiájának szintjéig történő leeresztését.
így a termékek változása expresszálható endotermikus és exoterm reakciókra (2.7., 2.8. ábra).
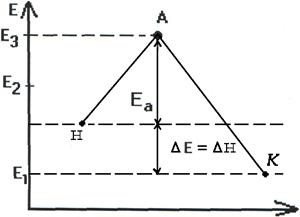
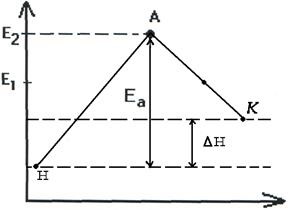
Általában az erős kovalens kötésekkel rendelkező anyagok közötti reakciókat az Ea nagy értékei jellemzik, és lassúak. Ez sok olyan interakcióra vonatkozik, mint például
amelynek sebessége normál körülmények között 0.
Az Ea kis értékei és nagyon nagy sebességek jellemzik az ionos kölcsönhatásokat a megoldásokban
A katalízis a reakciósebesség gyorsulását jelenti olyan speciális anyagok jelenlétében, amelyek mennyisége nem változik a reakció során.
Ezek az anyagok csak felgyorsítják a reakciósebességet, de nem áramlik el áramlásuk következtében.
A katalizátorok részt vehetnek a köztes reakciótermékek kialakításában, de az interakció végén teljesen regenerálódnak.
A lassítási reakciókat gátlók (negatív katalizátorok) segítségével végezzük.
- A katalízis során a reakció hő hatásának nagysága nem változik.
- Ha a katalizált reakció reverzibilis, a katalizátor nem befolyásolja az egyensúlyt, nem változtatja meg a Kp és a rendszer komponenseinek egyensúlyi koncentrációját. Ugyanúgy gyorsítja a közvetlen és a reverz reakciót.
- A katalizátorok szelektív módon, szelektíven működnek.
A katalizátor, amely aktívan gyorsítja az egyik interakciót, közömbös a másikhoz.
Ugyanabból az anyagból különböző termékeket kaphatunk különböző katalizátorok alkalmazásával.
Egyes anyagok csökkentik vagy teljesen elpusztítják a katalizátor aktivitását, katalitikus mérgek - arzén, ólom, cianid vegyületek.
A katalizátor aktivitását növelő adalékanyagokat promotereknek nevezik.
A katalizátor aktivitása, szelektivitása és élettartama nagymértékben függ a katalitikus reakció hőmérsékletétől.
Vannak katalizátorok, amelyeknek nincs specifikusságuk, egyetemesnek nevezik őket. Ezek közé tartoznak a fémes Nl. Pt. Palladium, amely katalizálja a hidrogénezés, oxidáció folyamatait. Sok folyamat autokatalitikus. Ezekben a reakciókban a katalizátor az egyik termék.
A láncreakciók olyan kémiai reakciók, amelyekben a közbülső aktív részecskék megjelenése nagyszámú (láncot) okoz az eredeti molekulák transzformációinak.
A szabad részecskék aktív részecskék, a gerjesztett molekulák gyökök - olyan részecskék, amelyeknek egy párosítatlan elektronja van.
A művek nagy szerepet játszottak a láncreakciók doktrínájának kialakításában
NN Semenova és S. Hinshelwood, akik ezen a területen végzett kutatásukért Nobel-díjat (1956) kaptak.
A láncreakciók számos lényegében fontos folyamat (krakkolás, polimerizáció, üzemanyag elégetés stb.) Alapját képezik.
Háromféle láncreakció létezik:
1. Nem elágazó láncokkal
2. Elágazó lánccal
3. Degenerált elágazással
Mindegyik típusú reakció három fázist tartalmaz - a láncok megindítását, fejlődését és törését.
A nem elágazó láncokkal végzett kémiai folyamatok a hidrogén és a klór kölcsönhatásának példáján alapulnak:
Ha a keveréket sötétben tárolják, akkor ez a reakció nem folytatódik a szokásos hőmérsékleten. A reakció gyors áramlására elegendő, ha elegendő mennyiségű fémes nátrium-gőzt vezetünk be a keverékbe.
A szakaszok reakcióséma a következőképpen írható le:
a) láncindítás
Az első szakaszban egy aktív részecske, egy szabad gyök vagy egy atom (C1) alakul ki láncindító reakcióban (a). A láncreakciók nagy aránya az aktív részecskék nagy reaktivitásának köszönhető.
A (b-d) reakciók kifejlesztésének második szakaszában az aktív részecske reagál a kiindulási anyag molekulájával, és egy új molekulát alkot, egy új aktív részecskével. A regenerált új részecskék újra reagálnak a molekulával stb. Így egy nem elágazó lánc keletkezik
számos link.
A gyökök vagy atomok molekulákkal való kölcsönhatásának aktivációs energiája nem haladja meg a 40 kJ / mol értéket. Az elemi kémiai reakciók lánchosszúsága eléri a 10 ezer és több százezer kapcsolatot.
A harmadik szakaszban a lánc megszakad (d-g). Ez az eredmény a vegyület (rekombináció) atomok per reaktor térfogata, elfog a fal, majd rekombináció a falak inaktív formában a radikális aktív fajok reagáltatva szennyeződések (járnak inhibitorok).