Oxidok - enciklopédia
Az oxidok a két elem atomjai által alkotott vegyületek. amelyek közül az egyik oxigén az oxidációs állapotban (-2).
Az oxidok magukban foglalják az összes oxigénelemet tartalmazó vegyületet, például a Fe203-ot. P4O10. kivéve azokat, amelyek oxigénatomokat tartalmaznak, amelyeket egymással kémiai kötés köt össze:
- peroxidok (Na2O2);
- szuperperoxidok (KO2);
- ozonidok (KO2).
és az oxigénnel (OF2, O2 F2) rendelkező fluorvegyületeket, amelyeket fluor-oxidok helyett fluorid-oxidoknak neveznek. mivel az oxigén oxidációjának mértéke pozitív.
Az oxidok fizikai tulajdonságai
Az oxidok olvadáspontja és forráspontja igen széles tartományban változik. Szobahőmérsékleten a kristályrács típusától függően különböző aggregált állapotban lehetnek. Ezt az oxidok kémiai kötésének természete határozza meg, amely lehet ionos vagy kovalens poláris.
Szobahőmérsékleten gázhalmazállapotú és folyékony állapotban oxidok alkotnak molekuláris kristályrácsokat. Amint a molekulák polaritása növekszik, az olvadáspont és a forrási hőmérséklet emelkedik (1. táblázat).
1. táblázat: Egyes oxidok olvadáspontja és forráspontja (101,3 kPa nyomáson)
Oxidák, amelyek ionos kristályrácsokat képeznek, például CaO-t. BaO és mások olyan szilárd anyagok, amelyek nagyon magas olvadáspontja (> 1000 ° C) /
Egyes kommunikációs oxidok kovalens poláris. Ezek kristályháló képzésére, amelyben az atomok kapcsolódó többszörös „áthidaló” oxigénatomot, képező végtelen háromdimenziós hálózat, például, Al2 O3. SiO 2. TiO2. BeO és ezeknek az oxidoknak is nagyon magas olvadáspontja van.
Az oxidok kémiai tulajdonságokkal való osztályozása
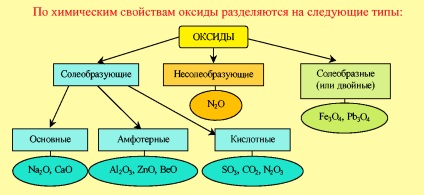
A nem oxigén-oxidok olyan oxidok, amelyekhez sem a savak, sem a bázisok nem felelnek meg.
A só-oxidok kettős oxidok, amelyek ugyanabban a fémben különböző oxidációs fokú atomokat tartalmaznak.
Például Fe3O4 → FeO · FeO3. az Fe2O3 amfoter-oxidhoz kémiailag kötött FeO bázikus oxidja. amely ebben az esetben savas oxid tulajdonságait mutatja. A Fe3O4 formálisan a Fe (OH) 2 és a sav [HFeO2] alapja által képzett sóként is tekinthető. amely nem létezik a természetben:
A sóképző oxidok olyan sók, amelyek sókat képeznek. Az ilyen típusú oxidok három osztályba sorolhatók: bázikus, amfoter és savas.
Az alapoxidok olyan oxidok, amelyeknek egy só vagy bázis kialakításakor kationt képeznek.
A savas oxidok olyan oxidok, amelyek elemei anionot képeznek, amikor sót vagy savat képeznek.
Az amfoter oxidok olyan oxidok, amelyek a reakciókörülményektől függően savas tulajdonságokat és bázikus oxidok tulajdonságait mutatják.
Az oxidáló anyagokat oxidáló állapotban lévő sók kialakulásakor nem változtatnak meg, például:
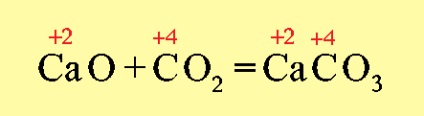
Ha a sóképzés változás oxidációs állapotai elemek képező oxidok, a kapott sót kell utalni egy sóját egy másik sav vagy más bázis, például:
Fe2 (SO4) 3 egy kénsav és vas (III) hidroxid - Fe (OH) 3 képződik. amely megfelel a Fe2O3 oxidjának.
A képződött sók a nitrogén (H + 3 NO 2) és a salétromsav (H + 5 NO 3) sói, amelyek megfelelnek az oxidoknak:
Az oxidok tulajdonságainak megváltozási mintái
Az oxidáció mértékének növekedése és az ion sugarának csökkenése (ebben az esetben az oxigénatomon levő effektív negatív töltés -δ0 csökken) az oxidot savasabbá teszi. Ez megmagyarázza az oxidok tulajdonságainak rendszeres változását az alapanyagtól az amfoterhez és savasabbá.
A) Egy sorban, ahogy növekszik a rendszám, az oxidok savas tulajdonságai megnövekszik, és a hozzájuk tartozó savak erőssége nő.
2. táblázat: Az oxidok sav-bázis tulajdonságainak függése az oxigénatomon lévő hatékony töltésen