Időszakos törvények és atomi szerkezetek, kémiai és kémiai készségek előkészítése
Az atom szerkezetének modellje
A XIX. Század végén - XX. Század elején végzett tudományos kutatás. lehetővé tette számunkra, hogy javasoljuk az atom szerkezetének következő modelljét:
- Az atom közepén egy pozitív töltésű mag magában foglalja az atom belsejében lévő tér elhanyagolható részét.
- Az egész pozitív töltés és az atom szinte teljes tömege koncentrálódik a magjában.
- Az atommagok protonokból és neutronokból (nukleonokból) állnak. A magban lévő protonok száma megegyezik az elem rendszámaival, és a protonok és neutronok számának összege megegyezik a tömegszámával.
- Az elektronok a zárt pályák mentén forognak a mag körül. Számuk megegyezik a pozitív nukleáris töltéssel.
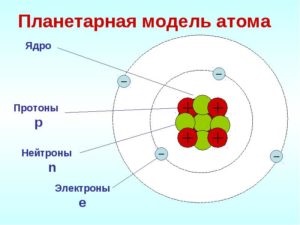
A mag az atom központi pozitív töltésű része, amelyben tömege koncentrálódik.
Az elektron egy negatív töltésű részecske, amely feltételesen -1-ben kerül elfogadásra.
A neutron semleges részecske, melynek nincs elektromos töltése. A neutron tömege 1 a. e.
A proton pozitív töltésű részecske, ugyanolyan tömegű, mint a neutron. A protontöltés megegyezik az elektron töltésével, és ellentétes a jelben.
Az atom magjában lévő protonok száma megegyezik az elektronok számával. Ez a szám határozza meg az elem atom atomjának töltését és a rendes számot az időszakos táblában.
Bizonyos körülmények között a neutron protontá alakítható és fordítva.
Az időszakos tábla elemeinek atomtömege az izotópok természetes keverékeinek tömegének átlaga. Ezért, mint Mendelejev úgy vélik, nem lehet az atom és az elem fő jellemzője. Ez a jellemző az atom magjának töltése. Meghatározza a neutrális atom elektronainak számát, amelyek a sejtmag köré oszlanak el bizonyos pályákon és meghatározzák az atomok kémiai tulajdonságait. Ennek eredményeképpen a kémiai elem új fogalommeghatározását adták, és az időszakos törvény megfogalmazását finomították:
A kémiai elem ugyanazon nukleáris töltésű atomok gyűjteménye.
Az elemek tulajdonságai, valamint vegyületeik tulajdonságai és formái rendszeres időközönként függenek az elem atomtömegétől.
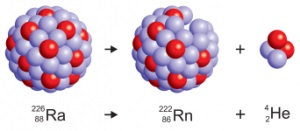
A Becquerel által felfedezett radioaktivitás jelensége volt a nukleáris reakciók első példája - az egyik elem magjainak átalakítása egy másik elem magjába. Most sok nukleáris reakció ismeretes; mindegyikük fizikai jelenségre utal, ezért nem tekinthetők a szokásos kémiai folyamatban.
A DI Mendeleyev időszakos törvényének alapvető rendelkezései
A kémiai elemek osztályozásának alapjaként Mendelejev elemi atomok tömegét vette át. Az atomi súlyok növekvő sorrendjében ismert elemekkel Mendeleev felfedezte, hogy az elemek tulajdonságait rendszeresen megismételik. 1869-ben fedezték fel Mengyelejev periódusos törvény 1871, így fogalmazott: „A fizikai és kémiai tulajdonságai elemek jelennek meg a tulajdonságait egyszerű és összetett szervek által alkotott őket, vannak rendszeres függés atomsúlyának.”
Most az atom egy elemhez való hozzáadását meghatározó fő jellemző az atom magjának töltése, amely megfelel az időszakos rendszerben lévő elem sorozatszámának. Ezért az időszakos törvény modern megfogalmazása a következő: az egyszerű anyagok tulajdonságai, valamint a kémiai elemek formái és tulajdonságai időszakonként függenek az elemek atomjainak töltésétől vagy az elemek atomszámától.
Például a lítiumtól a neonig terjedő sorozatban, amikor a magok növekedése növekszik, az elemek tulajdonságai nagyon határozott irányba változhatnak. Az egymást követő elemek lítium-nitrogén oxigénfaktorát egyenként megnövelik, és a szén-fluoridtól való hidrogén-valencia ellenkezőleg, egyenként csökken. A lítiumtól a fluorig terjedő fémes tulajdonságok fokozatosan gyengülnek, és a nem fémes tulajdonságok erősödnek.
A nátrium-argon sorozatban az elemek tulajdonságai nagymértékben megismételik az elemek tulajdonságait a lítiumtól a neonig. És az ismétlés egy bizonyos sorrendben nyilvánul meg: a nátrium ismétli a lítium, magnézium-berillium, alumínium-bór és így tovább. Az argon után a kálium megismétli a nátrium és a lítium, a kalcium-magnézium és a berillium tulajdonságait, vagyis az időszakos rendszer elemeinek tulajdonságait ismételjük meg. Ez az időszakosság nem tekinthető a tulajdonságok egyszerű ismétlésének. Az elemek tulajdonságait azonban különböző mértékben ismételjük meg.
Az elemek egész sorát egyetlen természetes rendszer - a kémiai elemek rendszeres rendszere formájában - képviselheti.
Az időszakos táblában minden elem 7 periódus. Az első időszak 2 elemet tartalmaz - hidrogén és hélium. A káliumtól a kryptonig és a rubídiumtól a xenonig a negyedik és az ötödik periódus már 18 elemet tartalmaz. A hatodik időszak 32 elemet tartalmaz. A hetedik időszak nincs vége. A kémiai elemek tulajdonságainak megismétlése időszakos. Az első három periódust kis, a másik nagy.
Ha kis sorozatokban növekszik a rendszám, akkor az elemek kémiai tulajdonságai egymást követõen változnak, majd nagy idõn belül az elemek bizonyos tulajdonságai ismétlõdnek az idõszakban.
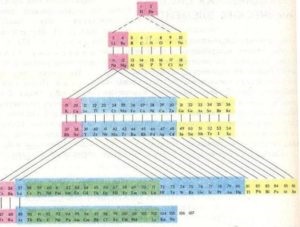
A kémiai elemek rendszeres rendszere táblázatos formában jeleníthető meg. A táblák sok különböző változata jött létre. Azonban a legnyilvánvalóbb és ezért a leggyakrabban használt a táblázat kibővített és rövidített formái.


Kibővített formában a táblázat kapunk, ha a időszakok egymást követő elemek helyezni formájában vízszintes sorok, hogy a hasonló elemeket a saját tulajdonságai bizonyultak szigorúan egymás felett. Ebben a táblázatban el vannak különítve rövid időszakokra - a 2. számú elem az elején és a végén a 6. táblázat, és a negyedik és ötödik időszakokban az elemek 10, a hatodik - 32 elemek (14 lantanidák együtt lantán helyezkednek el ugyanabban a ketrecben); csak 10 oszlopot. A táblázat függőleges oszlopaiban hasonló tulajdonságokkal rendelkező elemek alkotnak alcsoportokat. A második és a harmadik rövid periódus elemeinek alcsoportjai a legfontosabbak, míg a fennmaradóak másodlagosak. Összesen 8. táblázat fő és 8 szekunder alcsoportok: összesen 16. A fő alcsoportok által kijelölt utótag „a” - la, Ha. Az alcsoportokat a "b" - Ib, IIb index stb. Jelöli.
A IIIb. Alcsoportban a lantanidok és az aktinidák családjának 14 eleme van, amelyek külön sorokként szerepelnek a főasztalon kívül. Ennek az az oka, hogy ezeknek a családoknak az elemei nagy hasonlóságot mutatnak a kémiai tulajdonságokkal, és a fő asztal egyik cellájába kerülnek.
Az időszakos táblázat táblázatában szereplő rövidített formában a fő és a másodlagos alcsoportok egy csoportba vannak csoportosítva, de vízszintesen eltolódnak oly módon, hogy a fő és alcsoportok elemei különálló oszlopokat képeznek. Nagy táblázatok rövidített formája két sorozatból áll. A leggyakrabban használt formában az asztal rövidített formája, tömörsége és könnyű használata miatt.
Az időszakos rendszer sok más formája is létezik:
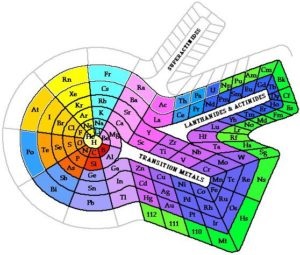
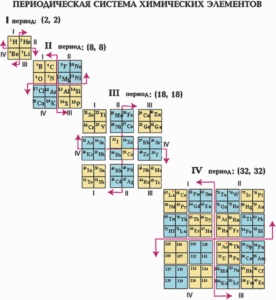
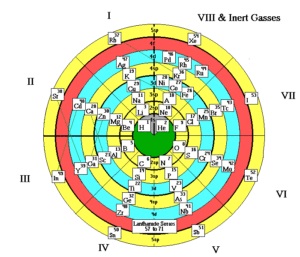
Az atom szerkezete és az időszakos törvény
Az atomok szerkezetének és a megfelelő elemek kémiai tulajdonságainak tanulmányozása az elektronok eloszlásának az atomok energiaszinten történő eloszlásával azt mutatta, hogy az elemek kémiai tulajdonságait elsősorban a külső elektronhéj szerkezete határozza meg.
Mivel az elemek kémiai tulajdonságainak megváltoztatásának időszakossága nem egyezik meg, vagyis az időszakos rendszer tartalmaz egy 2 elem időtartamot, kettőt 8, kettő 18 és egy 32 elem esetében. Az utolsó, hetedik időszak nem teljes, és 19 elemet tartalmaz. Az ilyen periódus összefügg az elektron energiaszintjének kitöltésével (Pauli elve, a Gund-szabály, a Klechkovsky-szabály):
Két szabály következik a fenti sorozatokból: bármely atom külső energiaszintjén nem lehet több, mint 8 elektron, és bármely atom létező energia szintjén nem lehet több, mint 18 elektron. Mivel bármelyik külső szint nem tartalmazhat több mint 8 elektront, a 8 elektront tartalmazó külső héjakot teljesnek nevezik. Ezek csak nemes gáz atomokra jellemzőek, és nagyon stabilak.
Az elektronikus héjak kialakításában elektronokkal töltött orbitálisoktól függően különbséget tesznek az s-, p-, d- és f-elemek között.
Annak tudatában, hogy az atomsorbiták elektronokkal töltődnek-e meg, megértik a kémiai elemek periódusos rendszerének jellemzőit. Mivel minden egyes periódus új elektronhéjat képez, az atom elektronhéjainak száma megegyezik az atom helyének számával. s - és p-elemek alkotják az időszakos táblázat fő alcsoportjait, a d- és f-elemek melléktermékek.
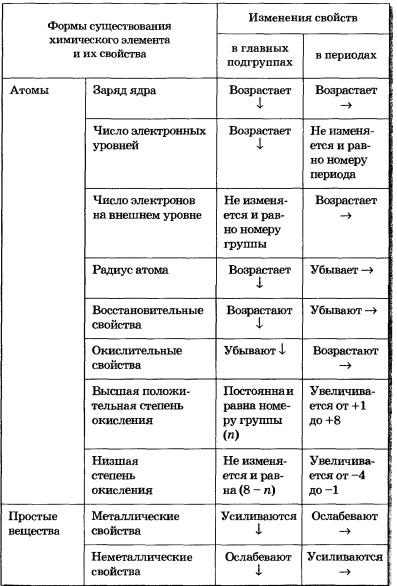
Az elemek tulajdonságainak változása az időszakokban és a csoportokban
A fő alcsoportok elemeiben (ezek az s és p elemek), a külső héj elektronainak száma megegyezik a csoport számával.
A külső elektronhéj összes d-eleme csak két elektront tartalmaz, mivel kitölti a már létező réteg d-pályáját. Ezért d-elemek. A tulajdonságok időbeli változásának természete ezen elemek esetében elsősorban az előtte lévő elektronhéj állapotának változásával függ össze. Ezért a d-elemek az időszakban, a tulajdonságok nem változnak élesen, mint az s vagy p-elemek, mind
A d-elemek fémek.
Az f-elemek elsősorban f-orbitálisokkal vannak kitöltve, melyeket a nyolc elektron elő-külső és két elektron külső héja fedez. Ezért az f-shell elektronikai konfigurációjának hatása a tulajdonságokra gyakorlatilag nem tükröződik, és az f-elemek annyira hasonlóak, hogy azokat az asztal egyik cellájába helyezik.