Jellemzői a kémiai kötések
Kovalens kémiai kötés és a fajtáit és mechanizmusok kialakulását. kovalens kötés jellemzőjű (polaritás, valamint a kötési energia). Az ionos kötés. Fémes kötés. hidrogénkötés
A tanítás a kémiai kötés az alapja az összes elméleti kémia.
Under kémiai kötés megérteni ez a kölcsönhatás alkilcsoport, amely összeköti őket, hogy a molekulák, ionok, gyökök kristályok.
Négyféle kémiai kötések: ionos, kovalens, fémes és a hidrogén.
Az osztály a fajta kémiai kötések feltétele, hiszen minden jellemzi őket egy bizonyos egysége.
Ionos kötéssel lehet tekinteni, mint egy korlátozó esetén poláris kovalens kötés.
A fémes kötés egyesíti kovalens kölcsönhatás atomok és elektronok szocializálódott elektrosztatikus vonzás útján között elektronok és fémionok.
Az anyagokat gyakran hiányoznak a kémiai kötés határesetben (vagy tiszta kémiai kötések).
Például, lítium-fluorid $ LiF $ utal ionos vegyületek. Tény, hogy felhívja a $ 80% $ ion és 20 $% $ kovalens. Helyesen így, nyilvánvalóan, beszélni a mértéke a polaritás (iontartalma) kémiai kötés.
Között halogenidek $ HF-HCl-HBr-lábcin $ kötődés polaritás csökken csökkentésére a különbséget az értékeket a elektronegativitása a halogénatomok és a hidrogén, valamint a hidrogén-asztatid kommunikációs válik szinte apoláros $ (EO (H) = 2,1; EA (At) = 2,2) $.
Különböző típusú kötvények lehet tartalmazott egy és ugyanazt az anyagot, mint például:
- a bázisok: az atomok közötti oxigén és hidrogén jelenlétében poláris kovalens kötés gidroksogrupp és a fém és gidroksogrupp - ion;
- oxigénezett savak sói: között nemfémes atom és oxigén-maradék - poláris kovalens, között egy fém és egy sav maradék - ion;
- .. A ammónium-, metil-stb közötti nitrogén és hidrogénatomok - poláris kovalens és ionok között vagy ammónium, és etil-metil-maradék - ion;
- egy fém-peroxidok (például $ Na_2O_2 $) közötti kötés oxigénatomok kovalens nem poláros és között a fém és az oxigén - ion, stb
Különböző típusú kapcsolatok is át egymást:
- amikor a elektrolitos disszociáció a víz a poláris kovalens vegyületek kovalens ionos kötést válik;
- elpárologtatása fémek alakítjuk fémes kötés kovalens nem poláros, stb
Ennek oka az egység minden típusú és fajtájú kémiai kötések ugyanolyan kémiai természetű - elektron-nukleáris kölcsönhatás. A kialakulását a kémiai kötés minden esetben annak az eredménye, elektron-nukleáris kölcsönhatás atomok kíséretében energia felszabadulással.
Módszerek kovalens kötés képzésére. Jellemzői kovalens kötés: a hossza a kötési energia
Kovalens kémiai kötés - kötés fordul elő, hogy az atomok között képződése miatt elektron párok közös.
A mechanizmusa formáció egy ilyen kapcsolat lehet cserélni, és a donor-akceptor.
I. csere mechanizmusa működik, ha atomok elektron párokat megosztott kombinálásával párosítatlan elektront.
Kommunikációs keresztül történik a kialakulását a teljes elektronpár $ s $ elektronok a hidrogénatomok (átfedő pályák $ s $):
2) $ HCI $ - hidrogén-klorid:
Kommunikációs történik képzésével egy pár közös elektronikus $ S- $ és $ p- $ elektronok (átfedő $ s-p- $ pályák):
3) $ Cl_2 $: klóratom a molekulában kovalens kötés képződik $ p- $ párosítatlan elektront (átfedő $ p-p- $ pályák):
4) $ n_2 $: a molekulában a nitrogénatomok között vannak kialakítva három közös elektron pár:
II. Donor-akceptor mechanizmus a kovalens kötés által a példája ammóniumion $ NH_4 ^ + $.
Donor elektronpár akceptor - szabad orbitális hogy ez a pár is igénybe vehet. Az ammónium-ion kapcsolatban mind a négy hidrogénatom kovalens három kialakítva azáltal, hogy közös elektronpárt a nitrogénatom és a hidrogénatomok a csere mechanizmusa, az egyik - a donor-akceptor mechanizmus.
Kovalens kötések szerint lehet csoportosítani, hogy a módszer az átfedés az elektron pályák, és az elmozdulás az egyik kapcsolódó atomok.
A kémiai kötések eredményeként képződött az átfedés az elektron pályák mentén kommunikációs nevezzük $ σ $ -bond (szigma-kötés). Szigma-kötés nagyon erős.
$ P- $ orbitálok átfedhetik a két területen, kovalens kötést miatt oldalirányú túlnyúlása:
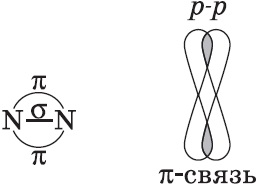
A kémiai kötések eredményeként keletkezett az „oldalsó” átfedés az elektron pályák a link, azaz, két területen, az úgynevezett $ $ pi-kötés (pi-kötés).
Mértéke szerint torzítás közös elektron pár csatlakozik az egyik kovalens kötés az atomok lehetnek poláros és nem poláros.
Kovalens kötés képződik szénatomjai között azonos elektronegativitása, az úgynevezett nem poláros. Electron pár nem kényszerült, hogy bármelyik csoport, mint atomok azonos EO - késleltetési tulajdonságot a maga vegyérték elektronok más atomok. Például:
azaz kovalens kötések nem poláros molekula-nonmetal egyszerű anyag. Kovalens kötés az atomok közötti elemek, amelyek különböznek elektronegativitási nevezzük poláris.
A hosszúság és az energia a kovalens kötés.
Jellemző tulajdonságai kovalens kötés - annak hossza és energiát. A kötés hossza - közötti távolság az atommagok az atomok. Kémiai kötés erősebb, minél kisebb a hossza. Ugyanakkor az intézkedés a kötés erőssége a kötési energia. amely által meghatározott a szükséges energia mennyisége megtörni a kötést. Általában mérjük kJ / mól. Így szerint kísérleti adatok, a hossza a molekulák $ H_2, Cl_2 $ és $ n_2 $ $ rendre 0,074, 0,198 és $ $ $ 0,109 nm, és kötést energiát rendre $ 436, $ 242 és $ 946 $ kJ / mól.
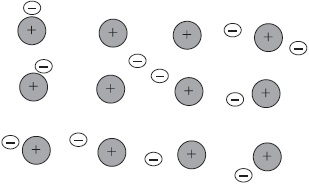
Ionok. ionos kötéssel
Képzeljük el, hogy „vannak” két atom: I. csoport fématomot és egy nemfémes atomcsoport VII. A fématom a külső energia szintje csak az elektron és atom nemfémes pontosan hiányzik egyetlen elektron annak külső szinten fejeződött.
Az első atom könnyű, hogy egy második távol a sejtmagban, és gyengén kötődik, elektron, és a másik ad neki egy szabad hely a külső elektron szintet.
Akkor az atom, megfosztva egy negatív töltése, akkor pozitív töltésű részecskéket, a második lesz a negatív töltésű részecskék miatt a kapott e. Ilyen részecskék nevezzük ionokat.
Kémiai kötés fordul elő, hogy a ionok, az úgynevezett ion.
Tekintsük a kialakulását ebben az összefüggésben, hogy a példa jól ismert összes vegyület a nátrium-klorid (konyhasó):
A folyamat a konvertáló az atomokkal ionok mutatja a következő rendszerben:
Ez az átalakítás atomok ionokra mindig megtörténik, amikor kölcsönhatásba atomok tipikus fémek és nemfémek jellemző.
Vegyünk egy algoritmus (szekvenciát), amikor a felvétel érvelés ionos kötés kialakulását a, például a kalcium-és klóratom:
- Kalcium - egy elem a fő alcsoportja csoport II fém. Atom könnyebb, így a két külső elektron, mint hogy a hiányzó hat: $ ↙-2e↖ → Ca ^ ↙ $.
- Klór - egy elem a fő alcsoportja Group VII nonmetal. Atom könnyebb, hogy elfogad egy elektron, amely hiányzik belőle a teljes a külső szinten, mint hogy hét az elektronok a külső szinten: $ ↙ + 1e↖ → Cl ^ ↙ $.
- Először is, meg a legkisebb közös többszörös között a díjak az előállított ionok, ez egyenlő $ 2 (2 × 1) $. Aztán meg, hogy hány atom kalcium meg kell venni, így ők a két elektront, azaz van szükség, hogy az egyik atom $ Ca $ és mennyit klór atomot kell venni, hogy azok is igénybe vehet két elektront, azaz meg kell, hogy két atom $ Cl $.
- Vázlatosan, a kialakulását között ionos kötést kalcium-és klóratom lehet írva, mint:
Ábrák számát mutató atomok vagy molekulák nevezzük együtthatók. és mutató számokra atomok száma a molekulában vagy ion, úgynevezett indexek.
fémes kötés
Ismerkedjen azzal, hogy hogyan hatnak egymásra atomok fém elemek. Fémek általában nem léteznek formájában izolált atomok, és abban a formában egy darab, vagy bugát a fém termék. Mi tartja a fém atomok egy helyen?
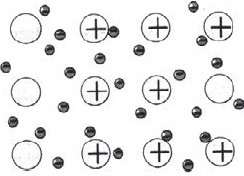
Az atomok legtöbb fém külsőleg tartalmazhat kis elektronok száma - $ 1, 2, 3 $. Ezek az elektronok könnyen jön le, és így atomok alakítjuk pozitív ionok. Stripped elektronok átkerülnek egyik ion a másikra, kötő össze őket. Csatlakoztatása a ionok, ezek az elektronok alkotnak átmenetileg atomok, majd leválasztjuk újra és kapcsolódik egy másik ion, stb Következésképpen, az atomok folyamatosan alakítjuk fémionok képernyőn, és fordítva.
Közötti kommunikáció a fémek ionok elektron szocializált úgynevezett fém.
Az ábra azt mutatja, vázlatosan a szerkezet egy fragmensének fémnátriumot.
Így egy kis számú elektron szocializált összeköti nagyszámú ionok és atomok.
Fémes kötés némi hasonlóságot kovalens, mivel alapul szocializációjába a külső elektronok. Azonban, amikor a kovalens kötés szocializálódott külső csak két párosítatlan elektront a szomszédos atomok, míg ha a fémes kötés a szocializációs ezen elektronok összes atom vesz részt. Ezért a kristályok törékenyek kovalens kötés, és egy fém, általában műanyagból, elektromosan vezető, és van egy fémes csillogás.
A fémes kötés jellemző mind a tiszta fémek és keverékei különböző fémek - ötvözet a szilárd és folyékony Államok.
hidrogénkötés
A kémiai kötés közötti pozitívan polarizált hidrogénatomok egy molekula (vagy annak egy részét) és negatívan polarizált atomok erősen elektronegatív elemeket, amelyek osztatlan elektronpár ($ F, O, N $ és ritkábban $ S $, és $ Cl $), egy másik molekula (vagy annak rész) nevezik hidrogénatom.
A képződésének mechanizmusát hidrogénkötés van részben elektrosztatikusan részben donor-akceptor jellegű.
Példák az intermolekuláris hidrogénkötések:
Ezzel kapcsolatban, még a kis molekulatömegű anyagok lehetnek folyadékok normál körülmények között (alkohol, víz) vagy könnyen cseppfolyósítható gázok (ammónia, hidrogén-fluorid).
Anyagok molekuláris hidrogénkötés van kristályrétegeiben.
Anyagok molekuláris és a nem-molekulaszerkezet. rács típusát. A függőség a tulajdonságai anyagok az összetétel és a szerkezet
Molekuláris és a nem-molekuláris szerkezete anyagok
A kémiai kölcsönhatások nem veszik az egyes atomok vagy molekulák és anyagok. Az anyag meghatározott körülmények között lehet egy három Államok aggregáció: szilárd, folyékony vagy gáz halmazállapotú. A tulajdonságai az anyag is függ a természet a kémiai kötés a részecskék közötti alkotó, hogy - molekulák, atomok vagy ionok. Szerint a kommunikáció típusát megkülönböztetni az anyag molekuláris és a nem-molekulaszerkezet.
A molekulákból álló anyag nevezett molekuláris vegyületek. Kapcsolat a molekulák között az ilyen anyagok nagyon gyenge, és sokkal gyengébb, mint az atomok között a molekulán belül, és viszonylag alacsony hőmérsékleten, töröttek - anyag válik folyadékot és további, hogy a gáz (szublimációs jód). Az olvadáspontokat és a forrásban lévő anyagok álló molekulákkal, amelyek növelik a molekulatömeg növekedésével.
A molekuláris anyagok közé tartoznak az anyagok atomi szerkezetének ($ C, Si, Li, Na, K, Cu, Fe, W $), köztük van fémek és nemfémek.
Tekintsük a fizikai tulajdonságai az alkálifémek. A viszonylag kis kötési szilárdság atomok közötti okoz alacsony a mechanikai szilárdsága: alkálifémek puha, könnyen késsel.
Nagy méretek atomok vezet kis sűrűségű alkálifémek: a lítium, nátrium és kálium is könnyebb, mint a víz. Abban a csoportban, az alkálifémek és a főzési hőmérséklet az olvadási csepp növekvő atomi száma az elem, mint atomi mérete növekszik, és gyengébb kötés.
Az anyagok nem-molekuláris szerkezetét ionos vegyületek. Így a szerkezet legtöbb fémek vegyületei a nem-fémek: mind sók ($ NaCl, K_2SO_4 $), néhány hidridek ($ LiH $) és oxidok ($ CaO, MgO, FeO $), egy bázis ($ NaOH, KOH $). Ionos (nonmolecular) anyagok nagy olvadási és a főzési hőmérséklet.
rácsok
Az anyag ismert, hogy létezik három állapot: gáz, folyékony és szilárd.
Szilárdanyag: amorf és kristályos.
Fontolja meg, hogy az adott kémiai kötések befolyásolja a tulajdonságait szilárd. A szilárd anyagot esnek kristályos és amorf.
Amorf anyagok nem rendelkezik tiszta olvadási hőmérséklet - melegítés közben fokozatosan meglágyult, és átvisszük egy folyékony állapotban. Az amorf állapot, például, az agyag és a különböző gyanták.
Kristályos anyagok azzal jellemezhetők egy szabályos elrendezésben a részecskék, amelyek állnak: az atomok, molekulák és ionok - szigorúan meghatározott térbeli pont. Csatlakoztatja ezeket a pontokat egyenesekkel teret képez keretet, az úgynevezett kristályrács. A pontok, ahol a részecske kristályrács nevű csomópontot.
Attól függően, hogy milyen típusú részecske elhelyezve kristályrácsban, és a természet a kapcsolat közöttük négyféle kristályrétegeiben: ionos, atomi, molekuláris és fém.
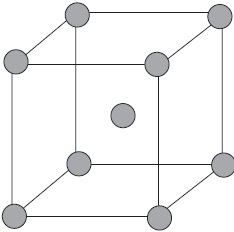
Az ionos kristályrács.
Úgynevezett ionos rácsok, amelyben az ionok csomópontok. Ezek az anyagok ionos kötést, amely lehet csatlakoztatni mind egyszerű, ionok $ Na ^, Cl ^ $, és komplex $ SO_4 ^, ^ OH - $. Ezért az ionos sók mutatnak kristályrétegeiben, néhány fém-oxidok és -hidroxidok. Például, a kristály nátrium-klorid váltakozásából áll pozitív ionok $ Na ^ + $ és negatív $ Cl ^ - $, amely egy rács a kocka alakú. Közötti kommunikáció az ionokat egy kristály nagyon stabil. Ezért, egy anyag ionrácsos viszonylag nagy keménység és tartósság, ezek tűzálló és nem illékony.
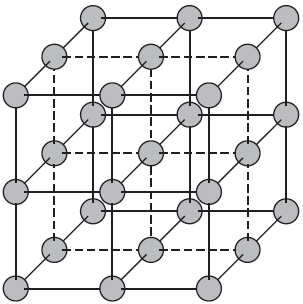
Az atomi kristályrács.
Úgynevezett atomi kristályrács, a csomópontok, amelyek az egyes atomok. Az ilyen rácsok-atomot tartalmaznak, összekötve nagyon erős a kovalens kötés. Példák anyagok ilyen típusú kristályrétegeiben lehet gyémánt - a szénatomok egyike allotropic módosításokat.
A legtöbb vegyületet egy atomi kristályrács igen magas olvadásponttal (például egy gyémánt felett $ 3500 $ ° C), ezek erős és kemény, szinte oldhatatlan.
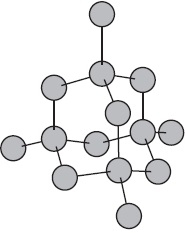
Molekuláris kristályrács.
Úgynevezett molekularács, amelyek székhelye a csomópontok a molekula. A kémiai kötés Ezek a molekulák lehetnek poláros ($ HCI, H_2O $), és a nem poláros ($ n_2, O_2 $). Annak ellenére, hogy az atomok a molekulák kötve nagyon erős közötti kovalens kötések a molekulák maguk a gyenge intermolekuláris erők a vonzás. Következésképpen azok a hatóanyagok molekuláris rácsok alacsony keménység, alacsony olvadáspontú, az illékony. A legtöbb szilárd szerves vegyületek molekularács (naftalin, glükóz, cukor).

Metál rácsok.
Anyagok fémes kötéssel van fém kristályrácsban. A csomópontok ilyen rácsok olyan atomok és ionok (atomok, hogy az ionok könnyen átalakíthatjuk a fém atomok, így a külső elektronok „általánosan használt”). Az ilyen fémek belső szerkezetét, hogy meghatározza a jellemző fizikai tulajdonságai: alakíthatóság, plaszticitás, elektromos és hővezető, jellegzetes fémes csillogás.