hő egyensúly egyenlet
Egy zárt (izolált külső szervek) termodinamikai rendszer-változás belül erejét bármely szervrendszer # 916; U1 nem eredményez változást a belső energia a teljes rendszert. ezért
Ha a rendszeren belül nem tesz a munka nem testek, akkor szerint az első főtétele, a változás belső energia a test kerül sor, csak a hőcsere a más szervek a rendszer: # 916; Ui = Qi. Figyelembe véve. kapjuk:
,
Ez az egyenlet az úgynevezett hő egyensúly egyenlet. Van Qi - száma hősugárzás általi-vagy adja el i edik test. Bármely mennyiségű hő is jelentheti, Qi keletkező hő vagy abszorbeált olvadása során egy test, égés, elpárolgás és a kondenzáció a gőz, ilyen eljárások fordulhat elő, ha különböző szerveket a rendszer, és meghatározza a megfelelő arányokban.
Hő egyensúly egyenlet egy matematikai kifejezés a törvény megőrzése Ener-giipri hőátadás.
Munka közben a gáz
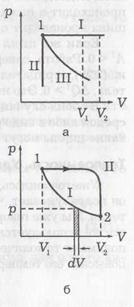
1 / V (lásd. Eq (4)). Táguló gáz munkát végez. Tegyük fel, hogy henger-dugattyú területe S hatására az állandó F erő következtében eltolódtak gáztágulásos távolságban yanie-dx. Gáz munka lesz egyenlő:
Ha f változott, akkor: (21).
A ris.b p # 903; dV - az a terület az árnyékolt csík, a - a területek összege minden csíkok V1 V2. T. o. munkagáz mérjük a görbe alatti terület az ábrán p -V. Nyilvánvaló, RA-bot függ a folyamat, vagyis. E. számít, ha a gáz expanzió történik a görbe mentén az I. és II görbe (ábrán látható. B görbe alatti II terület nagyobb, mint a görbe alatti I).
Amikor izobár folyamat (ábra, és a görbe I ..) munkagáz:
Amikor izochor állapotváltozás (ábra. A. II görbe) a térfogat nem változik, vagyis a. E. DV = 0 és ennek következtében-telno, A = 0. Az izoterm folyamat változások és p. és V (ábra. b). Cseréje nyomás révén a mennyiség és a hőmérséklet, a következő egyenlet szerint (4), megkapjuk a gázhoz T = const:
Döntetlen a gáz expanziós folyamat állapot 1 (ábra b.) Az állami 2. görbe II (A> 0), és vissza a tömörítési állapotát 1 - I. görbe (A<0 ). Процесс с возвращением в ту же точку называется цик-лом. Тогда общая работа будет равна разности площадей под кривыми II и I, т. е. пло-щади цикла.
Ha a ciklus p -V diagramok tenni az óramutató járásával megegyezően-ke (lásd. Ábra. B), a művelet a bővítés nagyobb, mint a tömörítés, és befejezni a munkát A> 0. Mivel mi vagyunk vissza ugyanarra a pontra, # 916; U = 0. tól (18) következik, hogy ebben a folyamatban, és a TEP-sok szállított a test, nagyobbnak kell lennie, mint nulla (Q> 0). Ez akkor fordul elő hőerőgép, hő hatására, és a ma-busz termel pozitív munkát.
Ha a ciklus végrehajtása az óramutató járásával ellentétes, akkor A <0. Соответственно и Q <0, т. е. энергия не подводится к телу, а отводится от него. Это имеет место в холодильнике.
Mindkét esetben van egy csere az energia és a környezet vagy a munka formájában, vagy egy hőcserélő.
eploemkost - a hőmennyiség korlátozza, amelyet át kell vinni, hogy a rendszer, hogy növelje a hőmérsékletet 1 (K) hiányában a hasznos munkát a állandóságát a megfelelő paramétereket.
Ha vesszük, mint a rendszer egykomponensű, a teljes hőkapacitása megegyezik a hőkapacitása a rendszer 1 mol vegyületet () szorozva móljainak a száma ().
A hőkapacitás specifikus lehet, és moláris.
Fajlagos hő - a hőmennyiség szükséges az anyag melegítése tömegegység per 1 ° (intenzív változó).
A moláris hőkapacitás - a hőmennyiség melegítéséhez szükséges egy mól 1 fok.
Megkülönböztetni a valódi és nagy a hőkapacitása.
A technika általánosan használt fogalom átlagos hőtároló képessége.
Átlagos - fajhője egy bizonyos hőmérséklet-tartományban.
Ha a rendszer tartalmaz az anyag mennyiségét vagy tömeg. számolt hőmennyiség. és a rendszer hőmérsékletét növeljük a előtt. ez lehet számítani az átlagos fajlagos vagy moláris hőkapacitás:
Igaz moláris hőkapacitás - az aránya infinitezimális hőmennyiségnek közölt 1 mol hatóanyagra egy előre meghatározott hőmérsékleten a növekményt egy hőmérséklet, amelynél ez figyelhető meg.
Szerint (19) képlet, a hőkapacitása, mint a hő nem egy függvény az állam. Állandó nyomáson vagy térfogat szerint egyenletek (11) és (12), hő és ezáltal a termikus kapacitása, és megszerezni a tulajdonságait a állami funkció, azaz jellemző a rendszer funkcióit. Így megkapjuk izochor és izobár hőkapacitása.
Izochor hőkapacitású - a hőmennyiség amelyet át kell vinni, hogy a rendszer, hogy növelje a hőmérséklet 1. ha a folyamat megy végbe.
Izobár hőkapacitású - a hőmennyiség korlátozza, amelyet át kell vinni, hogy a rendszer, hogy a hőmérséklet 1.
Hő-kapacitás nem csak attól függ a hőmérséklet, hanem a térfogatváltozás a rendszerben, mivel a kölcsönhatás erők a részecskék közötti, amelyet megváltoztatásával módosítható a közöttük levő távolság, azonban az egyenletekben (20) és (21) segítségével a parciális deriváltak.
Entalpiája ideális gáz, valamint a belső energia a hőmérséklet függvénye:
és összhangban Mengyelejev-Clapeyron egyenlet. majd
Ezért, az ideális gáz egyenletek (20), (21) a részleges származékok helyettesíteni lehet teljes differenciálművek:
A közös megoldások egyenletek (23) és (24) és (22) megkapjuk a kapcsolatot az egyenlet az ideális gáz.
Felosztása a változók egyenletekben (23) és (24) ki tudjuk számítani a változást a belső energia és entalpia melegítésével 1 mól ideális gáz hőmérsékletét, hogy
Ha a hőkapacitása említett hőmérséklet-tartományban lehet állandónak tekinthető, az eredmény integrálása, kapjuk:
Ahhoz, hogy megállapítsuk, milyen viszonyban az átlagos és az igaz hőkapacitása. Megváltoztatása az egyik oldalon a entrópia által kifejezett egyenlet (27), a másik -
Egyenlővé jobb oldalán egyenletek és kifejező nagy a hőkapacitása, van:
Egy hasonló expressziós lehet származtatni a közepén a izochor hőkapacitás.
A hőkapacitása a legtöbb szilárd, folyékony és gáz halmazállapotú anyagok a hőmérséklettel növekszik. A függőség a fajhője szilárd, folyékony és gáz halmazállapotú anyagok hőmérséklet által kifejezett empirikus egyenlet formájában:
ahol a. b. és c - empirikus együtthatók alapján számított a kísérleti adatok. ahol az arány kifejezés olyan szerves anyagokat, és - a szervetlen. A együtthatók értékét különböző anyagok vannak felsorolva referencia és alkalmazható csak a megadott hőmérséklet-tartományban.
A fajhő az ideális gáz nem függ a hőmérséklettől. Szerint a molekuláris-kinetikai elmélet hőkapacitása fokonként szabadságot egyenlő (szabadsági foka - a több független típusú mozgás, amely bontható összetett mozgást a molekula). Az egyatomos jellemzett molekulákból progresszív mozgást, hogy lehet bontani három komponens szerinti három egymásra merőleges irányban három tengely mentén. Ezért az izochor hőkapacitása egy egyatomos ideális gáz egyenlő
Ezután, izobár hőkapacitása egy egyatomos ideális gáz, szerint (25) fogja meghatározni a következő egyenlettel
Kétatomos molekulák ideális gáz Amellett, hogy a három szabadsági fokkal rendelkező transzlációs mozgás és két szabadsági fok a forgó mozgás. ezért: