Intermolekuláris kölcsönhatások - a Nagy Szovjet Enciklopédia
I moláris intermolekuláris kölcsönhatás e ystvie. közötti kölcsönhatás elektromosan semleges molekulák vagy alkilcsoport; meghatározzák a létezését folyékony és molekuláris kristályok. Ellentétben a valódi gázok ideális manifesztálódik különböző fizikai jelenségek. Az intermolekuláris kölcsönhatás függ a távolság R molekulák közötti, és általában ismerteti a potenciális kölcsönhatási energia U (r) (intermolekuláris kölcsönhatási potenciál), mivel ez az az átlagos potenciális energiája kölcsönhatás határozza meg az állam és tulajdonságai sok anyag.
Ez az első alkalom az intermolekuláris kölcsönhatás figyelembe vette a JD van der Waals (1873), hogy ismertesse a tulajdonságait valódi gázok és folyadékok. Van der Waals azt javasolta, hogy a kis távolság r közötti molekulák taszító erők, amelyek váltakoznak a távolság növelésével vonzóerők. Alapján ezek a gondolatok nélkül is figyelembe véve a mennyiségi függését az intermolekuláris kölcsönhatás a távolság, ez volt az úgynevezett Van der Waals állapotegyenlet egy igazi gáz.
Az intermolekuláris kölcsönhatás elektromos jellegű, és áll a vonzóerők (orientáció, az indukció és diszperzió), és taszító erők.
Orientációs erők hatnak közötti poláris molekulákat. azaz olyanokat, amelyek az elektromos dipólmomentum (lásd. Elektromos dipól). A vonzóerő a poláros molekulák maximális abban az esetben, amikor a dipólus momentum fekszenek ugyanazon vonal mentén (ábra. 1). Ez az erő annak a ténynek köszönhető, hogy a távolság a szemben hátba egy kicsit kevesebb, mint között az azonos nevet. Ennek eredményeként, a dipól vonzás meghaladja taszítás. dipól kölcsönhatás függ a relatív orientációja, és így szilárdsága orientációs nevezett dipól kölcsönhatás. Véletlen hőmozgás folyamatosan megváltoztatja a tájékozódás poláris molekulákat. de, mint a számítás, az átlagos összes lehetséges orientációban a erő értéke egy bizonyos értéket nem egyenlő nullával. A potenciális energia az intermolekuláris kölcsönhatás uvagy orientáció (R)
R -7. Mert erőssége a távolsággal csökken sokkal gyorsabb, mint a Coulomb-erő közötti kölcsönhatás töltött testek (Fkul
Indukciós (vagy polarizáció) erők hatnak a poláros és nem poláros molekulák. Polar molekula egy elektromos erőteret, amely polarizálja a molekula elektromos töltések egyenletesen elosztva a térfogata. A pozitív töltéseket irányban eltolódik az elektromos mező, és negatív - ellen. Ennek eredményeként, a nem-poláris molekuláknak indukált dipólmomentum.
p1 egy 2 / r 6. Ez az úgynevezett indukciós energiát, mivel úgy tűnik, molekuláris polarizáció. okozta elektrosztatikus indukció. Indukciós erők (Find
Két nem-poláris molekuláknak, hat diszperzió intermolekuláris kölcsönhatást. A természet ezt a kölcsönhatást már tisztázott teljesen csak létrehozása után a kvantummechanika. Az atomok és molekulák egy bonyolult módon, elektronok mozogni a magok. Az idő átlaga dipólusmomentumának nem-poláris molekuláknak nullával egyenlő. De minden alkalommal, az elektronok elfoglalni egy bizonyos helyzetben. Ezért, a pillanatnyi értéke a dipólus momentum (például a hidrogén-atom) értéke nem nulla. Pillanatnyi dipólus egy elektromos erőteret, amely polarizálja a szomszédos molekula. Ennek következtében felmerül kölcsönhatás dipólus instant. A kölcsönhatási energia közötti nem-poláris molekulák átlagos interakció eredményeként minden lehetséges instant dipólusok a dipólus momentum. hogy indukálják a szomszédos molekulák indukció. A potenciális energia az intermolekuláris kölcsönhatás Udisp diszperziót (R)
R -7 (itt A 1 és A 2 - polarizálhatóságot kölcsönható molekulák). Intermolekuláris kölcsönhatások Az ilyen típusú úgynevezett diszperziós úgy, hogy a diszperzió a fény egy közeg tulajdonságai határozzák meg a molekula. és ez a kölcsönhatás. Diszperziós erők hatnak közötti összes atomok és molekulák. mint a mechanizmus a megjelenésük nem függ, hogy a molekulák (atomok) állandó dipólmomentum vagy sem. Általában ezek az erők kiváló nagyságrendű, mint az orientációs és indukciós. Csak a kölcsönhatás a molekulák nagy dipólusmomentumának. mint például a vízmolekulák. A> Pdisp (3-szor a vízmolekulák számára). Amikor a kölcsönhatás a poláris molekulák. mint a CO, HI, HBr, és más, diszperziós erők jobbak a többi több száz alkalommal. Lényeges, hogy mind a három fajta intermolekuláris kölcsönhatások ugyanúgy csökken a távolság:
taszító erők hatnak a molekulák között nagyon kis távolságok, amikor érintkezésbe kerülnek a megtöltött elektron héj atomok. tagjai a molekulák. Meglévő a kvantummechanika, a Pauli-elv tiltja behatolását a megtöltött elektronhéjak egymásra. Emerging a taszítóerők függ, hogy nagyobb mértékben, mint a vonzóerők az egyedi molekulák. Egy jó egyezést mutat a kísérleti adatok eredményeket a feltételezést, hogy a potenciális energia UOT erők taszítása csökkenésével növekszik távolság jogilag UOT (r)
Ha feltételezzük, hogy az U (r) = 0, r ® ¥. és úgy vélik, hogy a vonzalom energia csökkenésével csökken távolság arányos r -6. és a taszítás energia megnövekszik, amikor r -12. a görbe U (r) lesz a ábrán bemutatott formában. 2. A minimális potenciális energia megfelel annak a távolságnak, amely felett a molekuláris kölcsönhatást erők nulla.
Számítsuk ki a kvantummechanika alapján a kölcsönhatásba lépő molekulák gyakorlatilag lehetetlen nagy változatossága pár kellő pontossággal U (r). Nem lehet még kísérletileg mérni az erejét intermolekuláris kölcsönhatások távolságon. Ezért általában úgy választjuk meg, képlet U (r), meg kell tenni a segítségével a számítások jól lehet összhangban a kísérletet. A leggyakrabban használt képletű
az úgynevezett Lennard-Jones potenciál. Általános képletben E és k értékeket határozzuk meg kísérletileg alapján a függőség Az anyagok tulajdonságainak (például, diffúziós együtthatók. Vezetés vagy viszkozitás) a S és E.
Irod Radchenko IV molekuláris fizika, Moszkva 1965 Coulson K. atomok közötti erőhatások - Maxwell a Schrödinger, „Advan Fizikai Tudományok” 1963-ban, azaz 81 .. 3; Hirschfelder J. R. Curtiss C. Bird, Molecular Theory a gázok és folyadékok. fordítás angolról, Moszkva, 1961.
Ábra. 1. Két elektromos dipól AB és CD az említett kölcsönös helyzetben vonzódnak, t. K. Ezzel ellentétes irányban díjakat a pont b és kölcsönhatásba több, mint az ugyanazt a díjat az A és C pontok (valamint b és d).
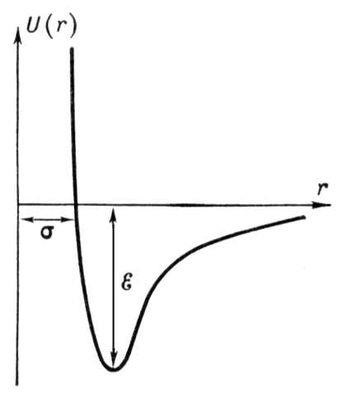
Ábra. 2. függőségi potenciálra U (r) intermolekuláris kölcsönhatás Lennard-Jones a távolság R molekulák közötti. A távolság r = s - lehető legkisebb távolságot a rögzített molekulák. e - a mélység a „potenciál jól” (a kötési energiája a molekulák).
