A redox reakció könnyen megtanulják
Redox reakciók - fellépő a változás az oxidáció mértékét az elemek.
Oxidáció - a folyamat visszarúgás elektronok atom
Recovery - elektronos folyamat atom órás
Redukálószer - az elem elektrondonor
Az oxidálószer - olyan elem, amely elektronokat
A vizuális, hanem egy egyszerűsített ábrázolása az oka a változások az elemek a díjakat az az ábra:
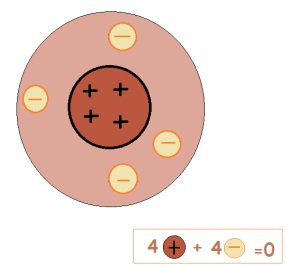
Egy atom elektromosan semleges részecskék. Ezért, a protonok száma megegyezik az elektronok száma
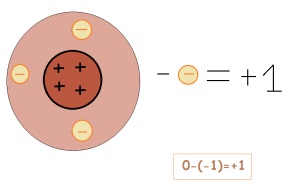
Ha egy elem biztosítja az elektron, a díj változik. Ez lesz a pozitív töltésű (ha elfogadja, akkor éppen ellenkezőleg, negatív)
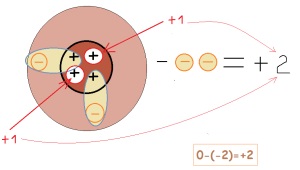
így a díjat elem befolyásolja az elektronok száma elfogadott vagy öntött
I. írása egyenletek redoxireakcióban vosstavnovitelnyh
1. Írjuk be a reakció rendszer
Na + Cl2 -> NaCl
2. Mi megszervezzük az oxidáció mértékét az elemek:
Na 0 0 + Cl2 -> Na + Cl -
3. Írunk elemeket változott az oxidációs számot, és hogy hány öntött / átvett elektronok:
4. Keresse meg a legkisebb közös többszöröse a számok a csatlakoztatott öntött és elektronok: