Van der Waals-egyenlet - ez
az egyik első igazi gáz halmazállapotban egyenletek. Azt javasolta 1873-ban Gaulle. fizikus H. D. Van der Waals (J. D. van der Waals). A mol gázt ad, amelynek a V térfogata a hőmérséklet a D-T és p nyomás adja meg:
ahol R - egyetemes gázállandó. és a és b - a kísérleti. állandók, amelyek figyelembe veszik az eltérést a kötő-az igazi gáz-kommunikáció ideális. Így egy / V2 nyomás tagnak van egy dimenziója, és lehetővé teszi a vonzás a molekulák eredményeként intermolekuláris kölcsönhatás, és az állandó b - Property korrekció. A kötet a molekulák, figyelembe véve a taszítás molekulák közelről. Magas V (és számára is ritka. Gázok) konstansok, és lehet elhanyagolni, és B y. belép ur beállított állapotában ideális gáz (Lásd. Clapeyron egyenlet).
B. y. yavl. közelítő és számszerűsíti a kommunikáció szigetek reális gázok csak a magas és az alacsony T p. Azonban, ez lehetővé teszi minőségileg viselkedésének leírására a gázt nagy p, és a kritikus gáz kondenzációs. állam.
Az ábra azt mutatja, az izotermák által kiszámított V. y. Alacsony T, mind a három gyökerek B. u.- valós, és meghaladja a kritikus. szívritmus-séklet (Tc) csak egy van akció. gyökér. Ez azt jelenti, hogy a T> TC a mennyiséget lehet csak egy (gáz halmazállapotú) állapotban és a T
- állapotegyenlet egy igazi gáz. Javasolt I. D. Van der Waals (J. D. van der Waals) 1873-ban a gáz, amely N-molekulák, B. y. Ez a következő:
ahol V - mennyiség, P - nyomás, T - absz. tempo-pa gáz, a és b - állandó, figyelembe véve a vonzás és taszítás a molekulák. A felhívott. ext. nyomás, az állandó b egyenlő négyszeresére a gáz térfogata molekulák, ha a modell egy molekula, hogy gyengén vonzza elasztikus szférában.
B. y. mennyiségileg meghatározni reális gáz tulajdonságok csak egy kis intervallumban T és p -. régióban viszonylag magas és alacsony T p, a és b-f-éval ráta-ry .. Azonban, B. y. Ez leírja minőségileg helyes viselkedését a gáz és a folyékony és magas P, és különösen a fázisátmenet közöttük. Alacsony nyomáson és magas aránya-pax belép ur beállított állapotában ideális gáz (Clapeyron egyenlet), és a nagy nyomású és alacsony-pax lehetővé kismértékben összenyomható folyadék. B. y. Leírja továbbá, kritikus és me-metastabil állapot a rendszer folyadék - gőz.
Ábra. megadott koordináták p - V izotermát, számítva B. y. a köbös tekintetében az V. Van 3 esetben AV megoldásokat. 1) mind a három gyökerei valós és egyenlő egymással; Ebben az esetben megfelel a kritikus. állapot (izoterma Ta 2) mindhárom gyökerek valós és más - az úgynevezett .. dokritich. állapot (T izotermák
Geom. helyezze a kezdeti és a végső pont „egyensúlyi” egy stabil és metastabil fázisok (meghatározva a feltétellel, hogy az árnyékolt területek) nevezzük. binodal (görbe ACN). Az összekötő görbe szélső pontjait típusú d, e, az úgynevezett. spinodal (görbe DKE). A terület közé bezárt binodal és spinodal, - instabil régióban, a metastabil állapot a rendszer-CIÓ. T. o. részeit izotermái típusa ad és ec rendre metastabil egyensúlyi túlhevített folyadék és folyadék + gáz rendszer. valamint a folyékony gáz + rendszer és a túlhűtött gáz. DBE résznek nat. értelemben, azaz a. k. ezen az oldalon együtt növekszik p és V, ami lehetetlen.
Megfelelően alacsony sebességgel-PAX ADB része alá esik izobár p = 0. Ebben az esetben, miután nat. szakasza értelmében hirdetés kerül otritsat. nyomást, amely megfelel instabil állapotban a feszültség a folyadék.
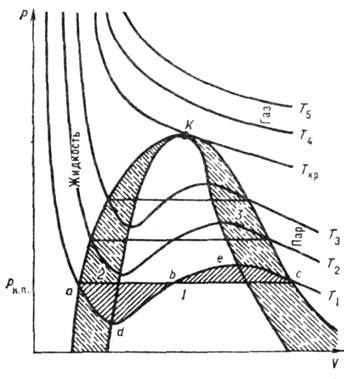
Ábra halmazállapot a p-V koordináták: T1 B. y. kaphat kritikus. RRC paramétereket. V KP és Tkp. A K pont izotermák Van der Waals-erők a maximális, és egy inflexiós pontot, t. F .. Az oldatot ur-ny Van der Waals erők, valamint a két fent megadott a formája: Annak ellenére, hogy a B állandó méltó karakter, molekulaméret, expresszióval megkaphatunk. jó egyezést mutat a vény al. módszerekkel. B. y. be-Roe megadott attribútumokat. értéke T / T c. p / PCR. T / T cr nevezzük. A fent niem ur állapotban; van egy szélesebb körű alkalmazását, mint a B. y. Ha B. y. nyomás bővült hatásköre a sűrűsége, és összehasonlítottuk a Virial bővítése, a konstansok a és b lehet kifejezni a Virial együtthatók. Irod cm. cikk értelmében. Gáz. Yu H. szereti
Kapcsolódó cikkek