A hatásmechanizmusa hormonok hidrofil
A hatásmechanizmusa hormonok hidrofil
A. A hatásmechanizmusa hormonok hidrofil
A legtöbb hidrofil jelző anyagok (lásd. P. 368) nem halad át a lipofil sejtmembránon. Ezért, a sejt szignáltranszdukciós keresztül membrán receptorokhoz (jelvezeték). Receptorok - a membránba ágyazódott fehérjék, amelyek kötődnek jelző anyag a külső oldalán a membrán és változása miatt a térszerkezetének generál egy új jelet a belső oldalon a membrán. Az adatjelet határozza meg géntranszkripció és enzimek aktivitását, amelyek szabályozzák az anyagcserét, és kölcsönhatásba lépnek a citoszkeleton.
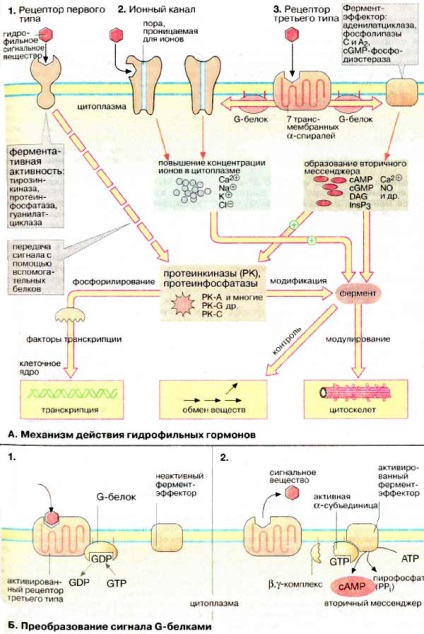
Három típusú receptorok.
1. Az első típusú receptorok fehérjék, amelyek egy transzmembrán polipeptid-láncot. Ez alloszterikus enzimek, aktív hely található, amely a belső oldalán a membrán. Sokan közülük protein-kinázok. Ahhoz, hogy ez a fajta tartozik az inzulin receptorok, növekedési faktorok és citokinek.
A kötési jelet anyagot vezet a receptor dimerizációját. Amikor ez bekövetkezik enzim aktiválását és a tirozin maradékok foszforilációját bizonyos proteinekben. Elsősorban foszforilált receptor molekulához (autofoszforilezést). A foszfotirozin-SH2 domén kötődik a proteinhez-vivőjelet (lásd. P. 378), amelynek funkciója, hogy átvigyen egy intracelluláris protein-kinázok jelet.
2. Az ioncsatornák. Ezek a receptorok a második típusú oligomer membrán fehérjék, hogy egy ligandumot képezve-aktivált ioncsatorna. A ligandum kötést vezet egy csatornát nyílást ionok Na +. K + vagy Cl -. Ilyen mechanizmus művelet hajtódik végre neurotranszmitterek, köztük az acetil-kolin (nikotinos receptorok: Na + - és K + csatornák), és # 947; aminovajsav (A-receptor: Cl - -csatorna).
3. Receptorok harmadik típus társított GTP-kötő fehérjék. A polipeptid-lánc, a fehérje tartalmaz hét transzmembrán szálak. Ezek a receptorok a jelet keresztül GTP-kötő fehérjék a effektor fehérjék, amelyek konjugált enzimeket vagy ioncsatornákat. A funkció ezen proteinek változtatni a koncentrációját ionok vagy a második messengerek. Így a kötődését a jel anyag a membrán receptor jár egy három intracelluláris választ: A receptor tirozin-kinázok aktiválják az intracelluláris protein-kinázok. Aktiválása ligand-aktivált ioncsatornák változásához vezet ionkoncentráció és receptorok aktiválásának társított GTP-kötő fehérjék, szintézisét indukálja anyagok közvetítésével másodlagos hírvivők. Mindhárom átviteli rendszerek összeköttetésben vannak. Például, a kialakulását a második messenger cAMP (cAMP) (lásd. P. 374) aktiválásához vezet, a protein kináz A [PC-A (PK-A)], a második messenger diacil-glicerin [DAG (DAG)] aktiválja a [PC-C (PK -C)], és a második messenger inozit-1,4,5-trifoszfát [IP3 (InsP3)] okoz megnövekedett a koncentrációja a Ca 2+ ionok a sejt citoplazmájába.
B. jel konverziós G-protein *
G-fehérjék át egy harmadik jelet receptor típusú fehérjék effektorok. Megépítésük három alegységből: # 945;, # 946; és # 947;. # 945; -cubedinitsa az a tulajdonsága, hogy kötődik a guanin nukleotidok [GTP (GTP), vagy HDF (GDP)]. A fehérje mutat gyenge GTPáz aktivitását és más hasonló GTP-kötő fehérjék, például a ras (lásd. P. 384), és a elongációs faktor Tu (EF-Tu) (lásd. P. 248). Inaktív állapotban a G-protein kapcsolt GDP.
Való kötődés után receptor szignál anyag harmadik típusú konformációja az utóbbi úgy változik, hogy a komplex nyereség a képességét, hogy kötődnek a G-proteint. Association of G-protein a receptorhoz vezet GDP cseréjét a GTP (1). Van tehát egy G-fehérje aktiválása, el van választva a receptor és disszociál # 945; alegység és # 946, # 947-komplexum. # 915; # 932; # 934 - # 945; alegység kötődik az effektor proteineket, és megváltoztatja azok aktivitását, ami a nyitását vagy zárását a ioncsatorna, aktiválása vagy gátlása enzimek (2). Lassú hidrolízisét kötött GTP GDP lefordítja # 945; alegység inaktív állapotban, és ez ismét társítva # 946, # 947-komplex, azaz a G-protein visszatér eredeti állapotába.
* A hazai irodalomban a G-fehérjék is nevezik N-fehérjék (lásd. Ovchinnikov, Yu A. "Bioorganic Chemistry", 1987, M. Education, pp. 240-242). - Kb. Trans.