Reakcióvázlat az ionos kötést
A fémek és hegesztési
Coulomb vonzóerő eredő kölcsönhatása töltésű ionok, erős és aktus azonos irányban teljesen ?? ex. Ennek eredményeként ez az elrendezése az ionok a térben meghatározott megrendelt ?? ennym módon, alkotó ionos kristályrácsban. Anyagok ionos KR normál körülmények vannak a kristályos állapotban, hogy van egy magas olvadási és a főzési hőmérséklet.
Fémek és ötvözetek kristályosodni formájában fém rácsok. Csomópontok egy fémráccsal által elfoglalt pozitív ionok a fémek. Vegyérték elektronok elválasztjuk a fématomok és a fennmaradó csomópontok a kristályrácsban ionok, többé-kevésbé szabadon a térben mozogni közötti kationok és hatására a villamos vezetőképessége fémek. Között az ionok és szabad elektronok keletkeznek elektrosztatikus kölcsönhatások, amelyek az oka a fémes kötés.
A fémes kötés van hasonlóságot mind ionos (következtében képződött közötti kölcsönhatás töltött részecskék: elektronok és ionok) és kovalens (elektron szocializáció történik, de ellentétben kovalens kötés, ahol az elektronok lokalizálódnak körül határozzuk ?? ennyh atomok, elektronok fémek kollektivizálták Sun ?? azt kristály). Szabad elektronok néha elektron gáz. Kationok fémes rácsok nincs transzlációs mozgás és oszcillálnak körül a helyzet a rács csomópontok. A amplitúdója e rezgések együtt növekszik a hőmérséklet, és amikor az olvadási hőmérséklet fém rács összeesik. Alacsony olvadáspontú fémek általában megnöveli a számát vegyérték elektronok az atomok.
Ezek közül kettő vagy több egyedi fém úgynevezett ötvözetek. A ötvözetek jelen lehetnek kis mennyiségben, és néhány nem-fémek (szén, kén, szilícium). A leggyakoribb módszer, hogy kapjunk egy közös fűtési ötvözetek azok komponensek, amíg a teljes olvadása a keveréket. Azonban néhány fémek nem egyesül egymással, minden tekintetben. Fémötvözetek a következőképpen osztályozhatók: szilárd intersticiális oldatok (rész intersticiális üregek elfoglalt rács atomok egyéb elementa͵ például szén-des ?? EZE-öntöttvas és acél); szubsztitúciós szilárd oldatok (alapanyag részhez atomok atom helyettesít, a szennyező elem-ón forrasztási, 64 tömegrész ón és 36-ólom); keveréke kristályok az egyes fémek; keveréke kristályok intermetalicheskih ?? eny kapcsolt (kondenzált fémek alkotnak kémiai összekötő ?? eniya-bronz van jelen kapcsolt ?? ix Cu3 Sn)
Van der Waals erők - intermolekuláris erők (és atomközi) kölcsönhatás energia 10 - 20 kJ / mól. Ez a kifejezés az eredetileg kijelölt Sun ?? e olyan erők modern tudomány azt általában alkalmazzák a fellépő erőhatások polarizációja molekulák és a kialakulását dipólus. OtkrytyYa. D. van der Waals-1869-ben.
Van der Waals erők atomközi in ?? ertnyh gázok hatására a lehetőségét aggregált Államok yn ?? ertnyh gázok (gáz, folyadék, szilárd testek).
A van der Waals-erők közötti kölcsönhatás dipólusok (indukált és állandó). A név abból ered, hogy ezek az erők okozzák korrekciókat a belső nyomás a állapotegyenlet egy igazi gáz van der Waals-erők. Ezek a kölcsönhatások és a hidrogén kötések, határozza meg a kialakulását a térszerkezet a biológiai makromolekulák.
Van der Waals-erők is merülhet fel a részecske (makroszkopikus részecske vagy nanorészecske), és egy olyan molekula, vagy két részecskéket
15. A módszer a vegyértékkötéseket. A fogalom a hibridizáció atomi pályák. A geometriája poliatomos molekulák: a modell Gillespie.
Módszer vegyértékkötés (MFR) más néven elmélete lokalizált elektron pár, mint a módszer azon a feltételezésen alapul, hogy a kémiai két atom közötti kötést keresztül hajtjuk végre egy vagy több elektrondonor párokat, amelyek lokalizált túlnyomórészt közöttük. Ellentétben az IMO, amely egyszerűen egy kémiai kötés kell lennie két- vagy több-központ, a MBC van ?? teljesen biztos, ha te két-elektron és két-központ. A számú elemi kémiai kötéseket, amelyek képesek képezni atom vagy ion, megegyezik annak vegyértékű. Csakúgy, mint a MMO, a kémiai kötés vegyérték elektronok vesznek részt. A hullám funkció állapotának leírásakor az elektronok képező kötés, az úgynevezett lokalizált orbitális (LO).
Megjegyezzük, hogy az elektronok által leírt LR szerint a Pauli-elv ellentétes irányú vissza, vagyis az MVS Sun ?? e forog párosítva van, és minden ?? e molekulák kell diamágnesesek. Következésképpen MFR elvileg tudja magyarázni a mágneses tulajdonságait a molekulák.
Mindazonáltal, az elv a helyi kötvények számos előnnyel rendelkezik, amelyek közül az egyik - a rendkívüli tisztaságot. MIF kellően, például jósolja a vegyérték-atomok és geometriája a kapott molekula. Ez utóbbi annak köszönhető, hogy az úgynevezett hibridizációs AO. Úgy vezették be, hogy ismertesse, hogy a két-elektron két központ fakta͵ kémiai kötéseket rovására JSC különböző energia államok ugyanaz az energia. Így, BE * (2s 1p 1 1), B * (2s 2p 2 1), a C * (2s 2p 1, 3) formában miatt az s - és p pályák, illetve két, három, vagy négy kötés, és ezért az egyik közülük meg kell erősebb, mint a másik. Ugyanakkor, a tapasztalat azt mutatja, hogy BeH2. BCI3. CH4 Sun ?? e kommunikációs egyenértékű. A BeH2 kötés szög 180 °, a BCI3 - 120 °, míg a CH4 - 109 ° 28”.
A koncepció szerint a hibridizáció, kémiai kötések alakulnak vegyes - hibrid pályák (GO), amelyek képviselik sebyalin ?? eynuyu AO kombinációs atom (ok - és p AOS Be, B, C), azonos energia és meghatározott formában ?? ennoy tájékozódás térben (szimmetria). Mivel az S - és p pályák adnak dvesp -edik szögben 180 ° egymáshoz képest.
Hibrid pályák és geometriája molekulák
Gillespie modell azon a feltételezésen alapul, hogy a kommunikációt hajtunk végre rovására egy elektronpár, és a geometriai szerkezetét a molekulák / ionok határozza meg az összes elektron párok körülvevő központi atom. Ebben az esetben a következő szabályokat kell alkalmazni:
· E párok közös ennye ?? és ?? nepodel ennye körül vannak elrendezve a központi atom úgy, hogy azok taszítás minimális, ᴛ.ᴇ. maximális távolságra vannak egymástól
· Nepodel ?? ennaya elektronpár foglal egy nagyobb volumenű, mint megosztani ?? ennaya
· Által elfoglalt térfogat kötő elektronpár kevesebb mint olshe elektronegatív atommal kötve egy központi
· Két elektron párokat kettős kötést vesz fel több, térfogata, mint egy pár egyszeres kötés
Hátrányok Gillespie modell
· A nem-alkalmazhatóságát a legtöbb csatlakoztatott ?? eny d-, s-elemek
· A nem-alkalmazhatóságát kapcsolódni ?? eniyam egy jelentős hányadát ionos jellege kommunikációs
· Képtelenség megjósolni a geometria a molekulák / ionok Intézet ertnoy nepodel ?? ?? ennoy elektronpárt
16. A módszer a molekulapályák. Alapvető fogalmak. Két-központ két-elektron molekulapályák. Energia diagramok Homonukleáris kétatomos molekulák kialakított elemeit az 1. és 2. kereteket. Mágneses tulajdonságok. A korreláció kommunikációs eljárások és az ionizációs energia. Egyszerű energia diagramok heteronukleáris molekulák (CO, HF, lítium-hidrid, H2 O).
A MOD-eljárás, feltételezzük, hogy a molekulában, mint egy atom, lehet építeni egy sor engedélyezett diszkrét energiaszinteket és a hullám megfelelő funkciókat őket (molekulapályák) viselkedését leíró egy elektron a molekulában. Minden energia szinten elhelyezhető legfeljebb két elektron. atomi pályák gyakran használják az építőiparban MO hullám funkciók (AO), amely leírja, hogy az egyes MO yi ling ?? eynuyu kombináció AB (MO LCAO).
Kiválasztása egy ilyen képviselet MO fizikailag teljesen világos: a közelében minden mag-molekula elektron viselkedését hasonlónak kell lennie, hogy a leírt viselkedést az atom, és az atom ennek megfelelő SA. Ebben az esetben a közelítő megoldás (mivel a molekulák Schrödinger-egyenlet kell megoldani csak kb!), Legalább ezeken a területeken lesz elég helyes. A régióban az atommagok Honvédelmi leírható szuperpoziciójával AO. A probléma megtalálásának MO hullám funkciókat ezáltal csökkenti a megállapítás az együtthatók. Azonban minden MO rendkívül fontos, hogy meghatározzák a megfelelő energiát.
17. A hidrogén molekula és módszerek annak leírását. A módszer a kémiai kötés, molekulapálya módszerrel. LCAO kezelést. A átfedése atomi pályák, szigma és pi-kötés, a sorrendben (multiplicitás) kapcsolat. Kémiai kötés a H2 részecskék. H2 - H2 + és a helyzetét a Honvédelmi Minisztérium és a fegyveres erők módszerekkel.
18. A kémiai kötés Homonukleáris kétatomos molekulák elemeit a második időszak attól a ponttól, MO és VB módszerek. MO rendszer molekulák kezdete és vége a második időszakban. Sorrendjének megváltoztatása kapcsolat, kötési energia, kötéshossz az átmenet Li2 a NE2. Jellemzői B2 és O2 molekulák. A kötés erőssége a molekulában N2
19. Heteronuciear kétatomos molekula elemeit a második időszakban. MO áramkör HF, CO, CN, OF. Sun és az orbitális hibridizációs módszer. Vegyérték állapotban az atom. Típusai hibridizáció és térszerkezetének molekulák Gillespie.
20. kovalens kötések poliatomos molekulák. Donor-akceptor kölcsönhatás. Lokális és delokalizált kötés. Három-központ kötvények. Orientációja és a telítettség kémiai kovalens kötés. VSEPR elmélet vegyérték héj és térszerkezete molekulák
Donor-akceptor kölcsönhatás - töltésátviteli között a donor és akceptor molekulák képződése nélkül közötti kémiai kötések őket (átváltási mechanizmus); vagy ?? ennoy nepodel transzmissziós elektronmikroszkópos pár a donortól az akceptor, így a képződését kapcsolat (donor-akceptor mechanizmus).
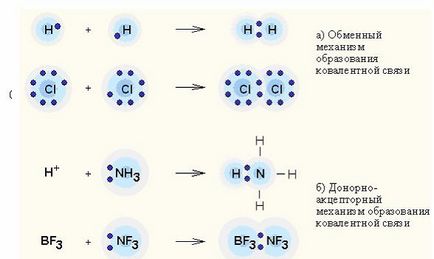
Kovalens kötés - a leggyakoribb formája a kémiai kötésre, amely miatt előfordul szocializációs elektronpár cseréje révén mechanizmus. amikor az egyes kölcsönható atomok szállít egy elektron, vagy egy donor-akceptor mechanizmus. ha a továbbított elektronpár a közös használatát egy atom (donor) egy másik atom (akceptor).
Delokalizált kötést - kötést elektronpár amely elterjedt több (több, mint 2) s yadr atomok (fémes kötés hasonlóság).
Kovalens kötést lokalizálható és delokalizált. Úgynevezett lokalizált kötés, amelyek osztoznak az elektronok ténylegesen ?? ének közötti két mag kötési atom. Ha az elektronikus kapcsolat megosztani ?? ének alatt a két mag, az egyik beszél, a delokalizált kötések.
Delokalizált kötést - jelentése kovalens kötés, molekulapályák amely több mint két atom.
Delokalizált kötések a legtöbb esetben π-kötés. Οʜᴎ jellemző konjugált rendszerek. Ezekben siste- max végzett speciális fajtája a kölcsönös egymásra hatás atomok - ragozás.
Konjugáció (mezo, a görög mesos -. Mean) - Az összehangolás kötéseket és díjak valós molekula (részecske) összehasonlítva egy ideális, de nem létező struktúrát.
Részvétel konjugációs delokalizált p pályák tartozhat két vagy π-linkek és több, vagy π-csatlakozás és egy atom p orbitális. Ennek megfelelően különbséget π, π-konjugáció és # 961 ;, π-konjugáció. konjugációs rendszer legyen nyitott vagy zárt, és tartalmazhat nemcsak szénatomok hanem heteroatomot.
Három-központ kételektronos kötést - az egyik lehetséges elektron-hiányos kötések. Azzal jellemezve, hogy egy pár vegyérték elektronok lokalizált a térben közvetlenül három atom (innen a term''elektrono-defitsitnosti „” - „” normalnym „” esetben két-központ kételektronos kötést). Általános leírás a mechanizmus az elektron kötések adják szempontjából az elmélet molekulapályák (model''nesvyazyvayuschih „” pályák).
A legnagyobb hozzájárulása a fejlesztés az elmélet trohtsentrovyh két-elektronos kötést végeztünk a tanulmány a bórhidridek és bór- csatlakoztatva ?? eny, ahol az ilyen kötődést végre nagyon gyakran (például diborán).
Lehet, hogy más elektron deficiens kommunikációt egy másik aránya a vegyérték elektronok és a kötött atomok. Az ilyen kötődés gyakran végrehajtott fém-joining ?? eniyah.
VSEPR elmélet vegyérték pályák (OEPVO) - az egyik megközelítés szükséges kémiai megmagyarázni és megjósolni geometriimolekul. Az elmélet szerint a molekula teljes egészében ?? ha te formájában fog, amelynél a külső elektronpár taszítás minimális (minimális energia elve).
Jellemző tulajdonságai a kovalens kötés - fókusz, telítettség, polaritás, polarizálhatóságának - meghatározzák a kémiai és fizikai tulajdonságok csatlakoztatva ?? eny.
Orientációja kommunikáció miatt a molekuláris szerkezete az anyag és a geometriai forma a molekula. A szögek közötti két kötést úgynevezett vegyérték.
Telítettség - a képessége korlátozott számú atomokkal kovalens kötés. A kötések száma által alkotott egy atom, arra korlátozódik, hogy a külső atomi pályák.
A polaritás a kapcsolatot, mert az egyenetlen megosztjuk ?? HAND elektronsűrűség miatt a különbség a elektronegatív atom. Ezen az alapon a kovalens kötések felosztva apoláros és poláros (apoláros - kétatomos molekula áll, amelyek azonos atomokból (H2 Cl2 N2) és az elektron felhők minden egyes atom vannak elosztva képest szimmetrikusan ezen atomok .. Polar - kétatomos molekula atomokból áll különböző kémiai elemek, és a teljes elektron felhő felé mozog az egyik atom, ezáltal egy particionált ?? eniya aszimmetria az elektromos töltés a molekulában, generáló dipólmomentum a molekula).
A polarizálhatóságot kommunikációs kifejezve az elmozdulás a elektronok hatása alatt egy külső elektromos mező, beleértve a és a többi reaktív részecskék. A polarizálhatóságának elektron mobilitás meghatározzuk. Polaritását és polarizálhatóságának kovalens kötések meghatározza a molekulák reakcióképességének a poláros reagensek.
21. A kémiai kötés típusai és a kristályok. Típusai kristályrétegeiben. Alapjai a zenekar elmélet. Kommunikáció fémek, félvezetők és dielektrikumokra. A hibák a kristályrácsban. Szilárd oldatok. Az ionos kötés. Kölcsönhatása ionok a kristályrácsban. Az energia az ionos kristályrács, a hatás mértéke és ionos töltések
Sáv elmélet - a leírás a mozgás az elektronok kristályok, az alapja a modern elmélet fémek, félvezetők és dielektrikumok.
A nagysága a sáv rés a legfontosabb változó, és meghatározza az elektromos és optikai tulajdonságait az anyag.
Vezetékek - anyagok, amelyekből a vezetési sáv és a vegyértéke sávok átfedik egymást alkotnak egy zóna - a vezetési sáv (elektron így szabadon mozoghatnak közöttük).
Szigetelők - anyagokat, amelyekből a terület nem terjed ki. Annak érdekében, hogy át egy elektront vegyértékelektronját a vezetési sávban van szükség, mert jelentős energiát, ezáltal dielektrikumok alig vezetőképes.
Félvezetők - az anyagok, amelyek nem fedik egymást övezetben. Annak érdekében, hogy át egy elektront vegyértékelektronját a vezetési sávba, akkor kevesebb energiát igényel, mint a villamos, ebben a tekintetben, tiszta félvezetők gyenge áram halad.
Molekuláris · - a molekuláris rács a molekula, benne rejlik a rács ?? Ix párosul kovalens kötés. Itt nem tartalmazza fémek (a hidrogénatom kivételével, Si)? Sun ?? e ?? egyesített szerves eniya H2SO4? HCI
· Atomic - a csomópontok atomok gyémánt, grafit - vízben nem oldódik tűzálló. nem oldható
· Ion - a csomópontok elrendezett pozitív és negatív ionokat, amelyek össze vannak kötve egymással elektromos vonzás só ionok. bázisként alkáli. Tartósság, a magas az olvadáspontja. Nem illékony. Sok vízoldható
· Fém - a csomópontok elrendezve fématomok, a hővezetési
lásd még
Coulomb vonzóerő eredő kölcsönhatása töltésű ionok és jogszabály egyformán erős minden irányban. Ennek eredményeként ez az elrendezése az ionok a térben rendezett egy bizonyos módon, alkotó ionos kristályrácsban. [További információ].