5 karbonsavak
A szerkezet a szerves karbonsavak, mint a funkciós csoport említhetők a karboxilcsoportot
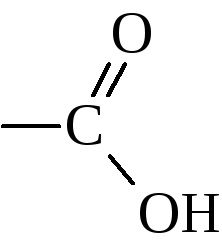
Attól függően, hogy ezek száma csoportot különböztetünk egy-, két-, három- ... többértékű sav. Attól függően, hogy milyen típusú csoportok képeznek a karboxil ezek jellemzően osztva alifás (telített és telítetlen), aliciklusos, aromás, stb
5.1 alifás karbonsav
5.1.1 telített egyértékű sav
Homológ sora ezeket a savakat kiindulási hangyasavval
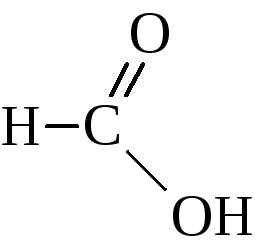
Izoméria a savszámot határozza meg szénhidrogéncsoport a szerkezet a karboxilcsoport és kezdődik a negyedik kifejezés a sorozat. Triviális nevek karbonsavak ojtott nagyon tartós és széles körben használt együtt a neveket IUPAC nómenklatúra. Nevek ezen nómenklatúra savak keletkeznek a megfelelő szénhidrogént név utótag -ovaya savat. Néha ezek a savak elemzi, mint az ecetsav származékai.
- alapuló módszerek az oxidációs:
a) oxidációja primer alkoholok (lásd a témában „hidroxi-vegyület”) .;
b) Az aldehid oxidációja (lásd a témában „Karbonil vegyület”) .;
c) oxidációja telített szénhidrogének a légköri oxigénnel a katalizátor. Az oxidációs syntin (lásd. Az alany „alkánok”), ez a módszer a savak elegye különböző lánchosszúságú és az iparban használt a termelés detergensek.
- hidrolízis nitrilek. vannak hatásával nyert kálium-cianid haloalkiiok
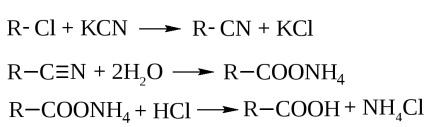
- hidrolízis iker trigalogenalkanov
- Szerves magnézium vegyület előállítása útján
- oxo - ipari gyártására szolgáló eljárást a karbonsavak. Ez az intézkedés a szén-monoxid, hogy olefinek (II) és a vízgőz 300 ... 400 ° C, a katalizátor (például Ni (CO) 4)
Hangyasav, ecetsav és propionsav folyó színtelen folyadék, jellegzetes, átható szag. Vízzel elegyedő minden tekintetben. Acid C4 - C9 - olajos folyadék. Vízben való oldékonyságuk erősen csökken a molekulatömeg növekedésével. Savak C10 és a fenti - szilárd kristályos anyagok vízben oldhatatlan.
A forráspontja az emelkedő molekulatömeg növekedésével. Összehasonlítva alkoholok, amelyeknek azonos számú szénatomot tartalmazó magasabb forráspontú sav. Például az etil-alkohol forr 78,3 ° C-on, és ecetsav - át 118,5 ° C-on Ez annak köszönhető, hogy a nagyobb-molekulák társulás és képződését a nagyobb szilárdságú társult. Fizikai mérések elsősorban pont a dimerizációra miatt hidrogénkötések.
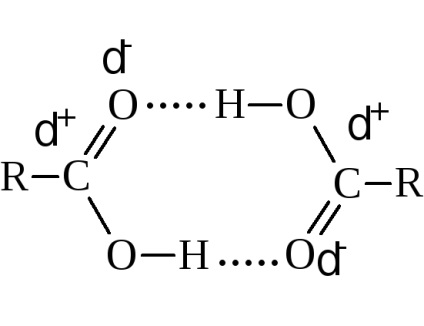
Savakat egy páros számú szénatomot tartalmazó olvadék magasabb hőmérsékleten, mint a savat egy páratlan szám.
- karbonsavak - egy protonsav. Amikor disszociáció-áció bocsátanak egy proton
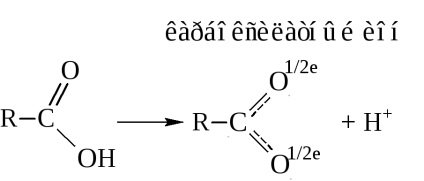
A savas tulajdonságokkal magyarázzák újraelosztása az elektronsűrűség a karboxilcsoport irányába oxigén.
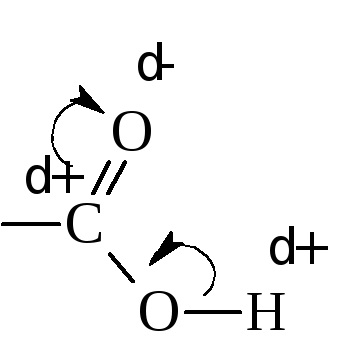
Mivel ebben az összefüggésben A - H legyengített és viszonylag könnyen törik. Az érték a disszociációs konstans ténylegesen függ a frakcionált pozitív töltés a karboxil szénatom. Minél nagyobb ez, annál erősebb a sav. A disszociációs mértéke, vagy, más szóval, az erős sav is függ a mérete és jellege a radikális. csatolt a karboxilcsoportot. Az alkilcsoportok indukciós hatása növeli az elektronsűrűség a karboxil (alacsonyabb pozitív töltés a karboxil szénatom), ezáltal csökkentve a sav erőssége.
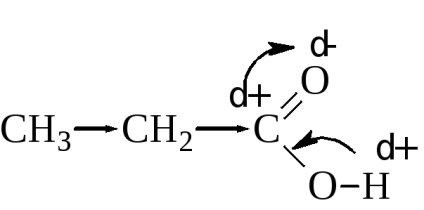
A növekedést az alkilcsoport a karbonsav disszociációs állandó valamelyest csökken. Így, hangyasav disszociációs állandója H-COOH 2,17 · 10 -4. ecetsav CH3COOH 1,76 · 10 -5 hexánsav CH3 és -CH2-CH2 -CH2-CH2-COOH 1,31 · 10 -5.
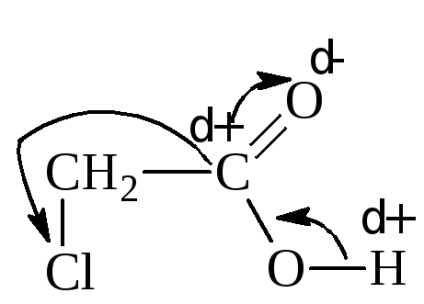
Bevezetés a radikális elektrofil, elektronoottyagivayuschey csoport, éppen ellenkezőleg, növeli az erejét a sav. Például, klórecetsav disszociációs konstansa 1,40 x 10 -3.
- Mint minden rendezi savakkal, karbonsavakkal sóképzésre alkalmas fémekkel, ezek oxidjai és hidroxidjai
Készítette pirolízis kalcium sók, az aldehidek és ketonok pirolízisével nátrium jelenlétében NaOH - szénhidrogének.
- Az akció a sav-halogenidek képződnek a foszfor-sav-halogeniddel vagy tionil-halogenid
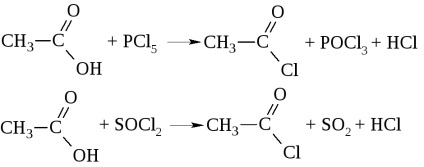
Savhalogenidek és a savat nevezik halogénatommal (-klorid ecetsav), valamint a sav acil-gyök
A halogén savhalogenidek rendkívül mobil és könnyen átmegy kicserélődési reakciók. Ok halogénatom mobilitás nagy pozitív töltést szén (δ +), amely közvetlenül csatlakozik a két atom elektronoottyagivayuschimi - oxigént és a halogént.
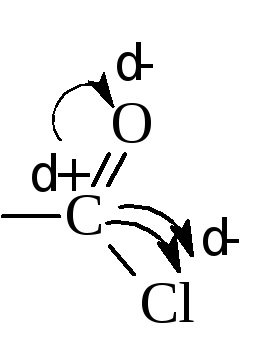
Ez a szén könnyen végbemegy egy nukieofil támadását a reagensek.
A reakciók halogenidekkel tartalmazó vegyületek fémeket vagy egy aktív hidrogénatom helyén fém vagy hidrogénatomok acilcsoport. Reakció nazyvaetsyaatsilirovaniem. Például, abban az esetben, ecetsav - is acetilezés.
Acilezése számos származékok előállított savat. sók, anhidridek, észterek, amidok, nitrilek stb például .:
a) hidrolízis vagy acetilezés-klorid vízben
b) alkoholízis a sav-klorid vagy acetilezéssel alkoholok
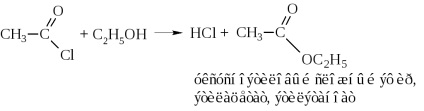
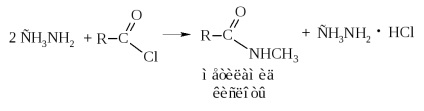
c) ammonolízis-klorid vagy ammónium-hidroxid-acetilezéssel
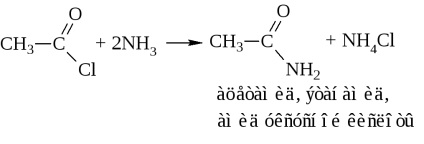
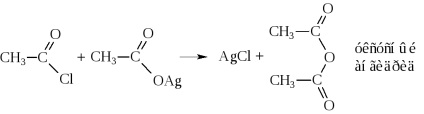
- Ennek eredményeként a víz eliminálása két molekula savanhidridek is készítenek
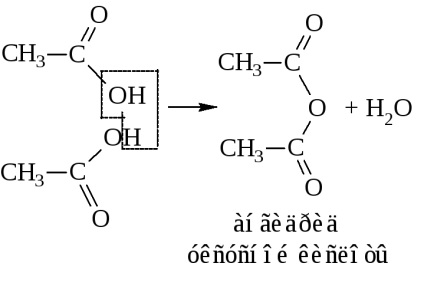
etánsav vagy anhidrid
Ily módon anhidrideket kapunk csak rendkívül mostoha körülmények között, akár a jelenlétében erős vízelvonó eszköz (P2 O5), vagy a katalizátor jelenlétében (Al 2O 3) magas hőmérsékleten. Ezek általában szintetizálják hatására savhalogenidekkel sót
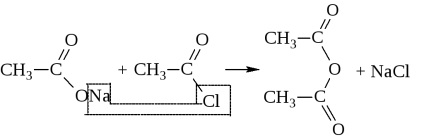
Képezhet egy anhidridből és két különböző sav.
Anhidridjei savak - az anyag nagyon aktív:
vízzel adnak a megfelelő savak
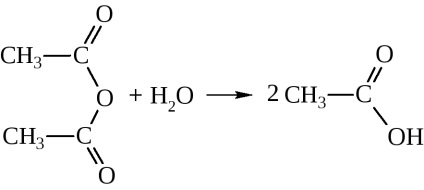
alkoholokkal és ammóniával keverékét képezve savak észterei és amidjai rendre.
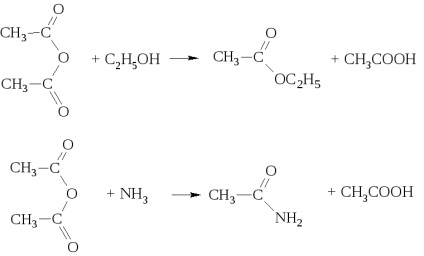
Anhidridek savak jó acilezőszerek. Azonban, a fele a molekula nem acilezett anhidridet, és izoláljuk a sav.
- amidok. Ezek általában keresztül állítjuk elő a sav-halogenidek és savanhidridek (cm. Fent). Iparilag szintetizált amidjai ammóniával sav
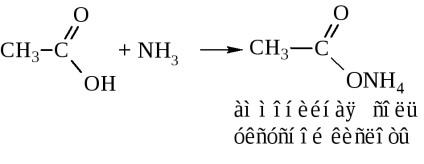
Amikor a száraz desztillációs-ammónium-só vizet szabadít fel az amid kialakítása céljából
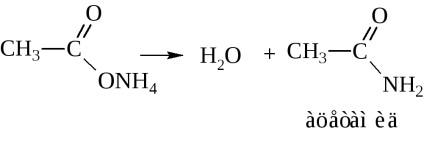
-acetamid IUPAC fogják hívni etanamidom.
Nyert aminok acilezésére és alkil-dialkil-amidok, amelyek az ipari értékét.
- észterek úgy állíthatók elő, közvetlen reakció a sav és az alkohol, azaz, észterezése alkoholokkal képezett jelenlétében savas katalizátor
Ez a reakció hosszú érdekelt vegyészek. 1862-ben, Berthelot találtuk, hogy obratimai egyensúlyi reakció akkor fordul elő, amikor reagálnak körülbelül PA2 / 3 mol a kiindulási anyagok. A késő tizenkilencedik század NA és NB Menshutkin találtuk, hogy az arány a észterezési reakció függ a szerkezet a sav és az alkohol. Azt találtuk, hogy az észterezés mértéke csökken számának növekedése és a térfogatot gyökök α-szénatom a karboxilcsoporthoz viszonyítva. Ez a tény nyilvánvalóan miatt árnyékolását a szénatom a karboxil-helyettesítő gyököket.
Tracer (oxigénizotópos 18 O) kimutatták, hogy a képződött víz az észterezési miatt a sav és az alkohol hidroxil-hidrogén
Names észterei triviális nómenklatúra a következőképpen készítjük: a neve a alkoholos csoport, plusz a nevét egy savcsoportot, ahol a végén -il helyébe -AT. IUPAC: a neve a alkoholos csoport, valamint a nevét a sav, amely helyébe a végén -ovaya -oat.
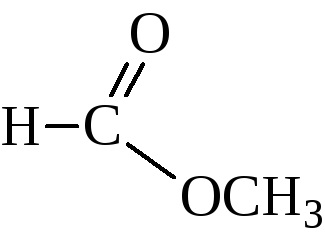
Amint fentebb látható, az észterek is elő alkoholok anhidridjei és savhalogenidek.
A reakciót alkoholok észterei tudnak cserélni őket gyökök. Ezt a reakciót nevezzük átészterezés.
Bár a karboxil-csoport van egy jelentős elmozdulás a elektronsűrűség az oxigén, a szénatom a karboxil még nem olyan nagy, pozitív töltést, például a szén-karbonil-ketonok és aldehidek. Ez annak köszönhető, hogy a részleges semlegesítést elektronikus szén telítetlen kötés elektronok tolva hidroxilcsoport
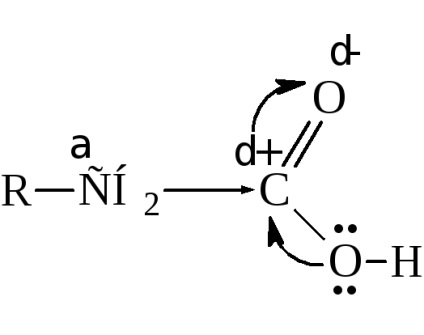
Mégis karboxil befolyásolja a hozzá csatlakoztatott szénhidrogéncsoport késlelteti az elektronsűrűség és növeli a tevékenység a hidrogénatomok, különösen α-szén.
Közvetlen klórozási vagy brómozási karbonsavak fordul elő a fényt feltételezés halogén Va-helyzetben.
A szokásos ugyanolyan módon sintezaα galogenzameschonnyh-savak egy olyan módszer, Gell-Folgand-Zelinsky. amely a fellépés karbonsav molekuláris klórral vagy brómmal jelenlétében foszfor
Egy másik módszer a szintézis, ami a β-halogén-szubsztituált savak gidrohlorirovaniiα, β-telítetlen karbonsavak
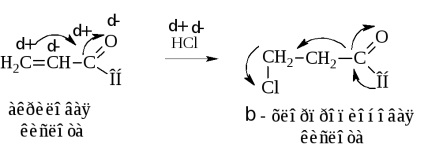
Csatlakozási HCl végbemegy ellentétes Markovnyikov szabály miatt az elmozdulás az elektronsűrűség a rendszer interfész oxigénmolekulák, és összhangban a díjak az atomok.
Action halogén savak hidroxi-savak is vezet a kívánt eredményt
Zameschenieα hidrogén-halogén-savval jelentősen javítja a szilárdságot. Halogén húz erőteljesen elektronpár származó α-szén, felfedve annak pozitív töltés. Ez viszont a karboxil szénatom vonzza az elektronokat hidroxilcsoport. Így, az indukciós hatás, hidroxil proton aktiválódik. Hasonló képet, bár kevésbé kifejezettek, figyelhető meg, amikor eltávolítjuk a halogénatomot a karboxilcsoport.
Amikor kicseréli a hidrogénatom sav I, Br, Cl, F, és növeli a halogénatomok száma, egymás után növeli a szilárdságot, és a sav disszociációs állandókat (K).
A halo köszönhetően a magas aktivitása a széles körben használt.
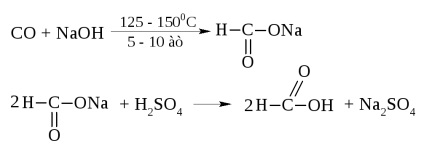
Hangyasav - folyadék formájában, forráspontja = 100,8 ° C, és a szúrós szaga. Bőrrel való érintkezés égési sérüléseket okoz.
Az iparban úgy állítjuk elő szén-monoxid és nátrium-hidroxid
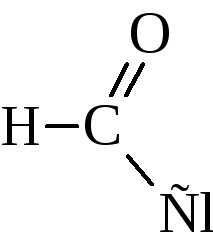
Hangyasav különleges helyet foglal számos savak. Együtt a karboxil lehet különíteni, és az aldehid-csoportot.
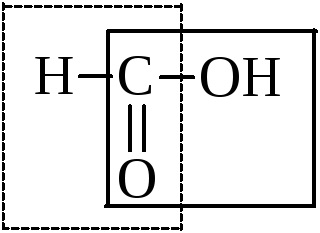
Ezért rendelkezik az összes tulajdonságait savak, belép az oxidációs reakció: egy ezüst tükör felingovoy folyékony - azaz a aldehid jellemzően a reakcióban.
Hangyasavat használunk fertőtlenítésre gyógyászatban és az iparban, Szövetek festése, bizonyos szintézisek során.
A vízmentes ecetsav hőmérsékleten +16,6 ° C megkeményedik, és ezért nevezik jég. forráspont. = 118,5 ° C
Készül hidratációs acetilén, etil-alkohol és az oxidációs telített szénhidrogének, acetát cukrok fermentációjával és egyéb módszerekkel.
Kémiailag - a hagyományos karbonsav.
Használni, mint egy kiváló oldószer bőr, festék, élelmiszer, vegyi és más iparágakban. És fogyasztott nagy mennyiségben.
Hosszabb szénláncú zsírsav-
A legismertebb a C15 H31 COOH palmitinsav és sztearinsav C17 H35 COOH. Ezeknek a savaknak van molekulát egy normális láncban a szénatomok. Ezeket úgy állítjuk elő az elszappanosítási zsírok és katalitikus oxidációját paraffinok.
A só ezeket a savakat - szappan. Nátrium- és kálium-sók; ezen savak könnyen oldódik vízben, és jól „mylyatsya”. magnézium-, kalcium-, bárium-, et al. (a keménységet okozó sók) gyengén oldódik vízben. Ezért, kemény vízben szappannal rendes átalakul oldhatatlan és nem „mylyatsya”.
Az A kúpok alkalmazásával szilárd keveréket magasabb szénatomszámú zsírsavak - sztearin.