A szerkezet a sarcomer és az izom-összehúzódás
A szerkezet a sarcomer és az izom-összehúzódás
• A miozin II egy motor, amely az izom-összehúzódás
• aktin és a miozin II fő összetevői sarcomerhossz, alapegysége a harántcsíkolt izom-összehúzódások
Az izomszövet képesek csökkentése, amely a mobilitás és a mozgás a test szerv. Összhangban a megjelenése összehúzó szálak, az izmok lehet osztani két fő csoportba sorolhatók: a harántcsíkolt és sima. Harántcsíkolt izomrostok úgynevezett, mert nagy nagyítások látható jellegzetes barázdáltságot. Ez a csoport magában foglalja a váz- és szívizom.
Vázizmok biztosítja a mobilitást a csontváz és a szívfrekvencia, a szív. A szálak a simaizmok nem harántcsíkolt és egy orsó alakú. Ezek az izmok képezik a falak a szervekben, például a húgyhólyag, a véredények és a gyomor-bél traktusban.
Motor fehérjét, amely az izom-összehúzódást családjába tartozik a miozin II. Ez a miozin az egyik leggyakoribb gerinces fehérjék, könnyen kiemelkedik, és így az egyik a jól tanulmányozott fehérjék.
Az alábbi ábra a szerkezet a miozin-II molekulák, amelyek hat polipeptid-lánc: két nehéz és két, amelyek mindegyike két könnyű lánc.
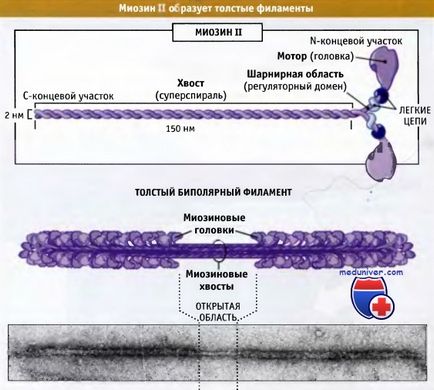
amely két nehéz láncot és két pár különböző könnyű láncok.
Ezeket a komplexeket összegyűjtjük bipoláris vastag filamentumok.
A távoli részét a farok izom miozin II molekulák társul más miozin II, olyan szálak képződnek, amely körülbelül 300 miozin molekulák. Ezek a rostok bipoláris és motoros doménjei miozinok irányítja a központi zóna. Ezeket a szálakat úgynevezett bipoláris vastag filamentumok. Ebben a részben arról lesz szó, a szervezet és a szerepe a miozin II csökkentésében harántcsíkolt izom. Ezek a kérdések jól ismertek.
Harántcsíkolt izmokat áll kötegek izomrostok. Az utóbbi nagy többmagvú sejteket, amelyek hossza változó: néhány millimétertől néhány centiméter, és átmérője 20-100 mikron. Az alábbi ábra azt mutatja, hogy minden egyes izomrost áll, több mint 1000 miofibrillumok, amelyek rúdszerű organellumok, amelyek képesek a csökkentésére. A miofibrillumok épülnek fel ismétlődő egységek úgynevezett szarkomer. Szarkomer elrendezve egymás mögött, és felelősek a jellegzetes barázdáltságot az izmokat.
Szarkomer az alapegysége harántcsíkolt izom rángások; amikor összehúzódása és ellazulása izomhosszt változásokat. Amint az ábra mutatja, tartalmaz szarkomer vastag szálak főleg a bipoláris szálak a miozin II, és a vékony szálak, amelyek aktin és szabályozó fehérjék. Feathered végei aktin egyrészt csatlakozik a sarcomer szerkezetet, amely az úgynevezett Z-lemez. Így az összes aktin egyik oldalán Z-meghajtó azonos polaritással.
Aktin filamentumok kapcsolódnak a Z-lemezt, és másolt kötéshez a protein tapogató (CapZ), amely megakadályozza, hogy a depolimerizáció a aktin. A hegyes végei aktin orientált közepe felé sarcomerhossz és másolja Tropomodulin. Mivel azonban az aktin filamentumok is kölcsönhatásba lép nebulin fehérje; ez szabályozza a szerelvény a szálak és a hossza a vékony szál.
Vastag filamentumok a központban, a M-vonal, a Z-meghajtók. M-vonal egy szerkezet, amely rugalmasan kapcsolódik a bipoláris vastag filamentumok; ezek a kapcsolatok rögzítse a vastag filamentumok, hexagonális elrendezésű belsejében. Együtt a M-line fehérje szálak úgynevezett titán-formák rugalmas kapcsolat a Z-lemezek és a miozin szálak. Titinius biztosítja központosítását a vastag filamentumok a szarkomerben, és működik, mint egy rugó, amely megakadályozza, hogy a szakaszon a szarkomerben.
Vékony és vastag filamentumok összefonódik, amely egy háromdimenziós rács. Mivel a bipoláris sarcomer, mindkét felét miozin motorok vonatkozásában aktin hasonlóan orientált. A csökkentés a motor domén miozin vastag szálak kölcsönhatásba aktin vékony szálak. A csökkentés a sarcomer lerövidül csúsztatva a vékony és vastag filamentumok egymáshoz képest, amely összehozza a szomszédos Z-meghajtók, hogy a központ a szarkomerben. Ahogy haladunk a miozinfejek szabdalják végei aktin, a hossza a vastag és vékony szálak az éhezés.
A szélessége a relaxált izom sarcomer gerincesekben körülbelül 3 mikron, miközben csökkenti válik körülbelül 2,4 mikron.
A izomrost csoportok lerövidülnek. amely több ezer szarkomer, ami egy rövidítés a teljes izom. A teljes hossza a rövidített izomrostok két tényező határozza meg: a hossza, hogy az egyes sarcomer lerövidült, és a szám a szarkomer a csoportban. Százalék mérete, amelyre létezik egy lerövidítése izomrostok ugyanaz, függetlenül azok hossza.
Az összeg által keltett erő sarcomerhossz. számával arányos akto-miozin kölcsönhatás fele sarcomer, és az az erő, amely fejleszti myshchnoe szál arányos a több párhuzamos szarkomer. Így, súlyemelők növelni erejüket növelésével a keresztmetszeti területe az izom, nem a hosszuk.
Amint az az alábbi ábrán, a csökkentés harántcsíkolt izom van szabályozva tropomiozinovogo troponin komplex, amely kapcsolatban van az aktin a vékony szálak. Tropomiozin molekulák olyan polipeptidek szupertekeredett 40 nm. Letette egymás mögött mentén aktin spirál. Troponin egy komplex három különböző fehérjék: troponin C, troponin I és troponin T. A komplex kötődik tropomiozin, hogy azok mentén vannak elrendezve, a vékony szálak 40 nm időközönként.
Alacsony kalciumion-koncentráció tropomiozin van olyan állapotban, hogy a tér blokkok kötőhelyet miozin aktin úgy, hogy az izom elenged, és az ATP hidrolízise által miozin hatása nagyon lassú. Kölcsönhatásán keresztül aktin miozin-nyugodt szarkomer képes passzív tenzió, kifejtő enyhe ellenállást.
Idegi impulzusok okozhat kalcium felszabadulást a citoszolba a szarkoplazmatikus retikulum. Az utóbbi egy organellum, hogy a kalcium lerakódások az izomban. Fokozott citoszolikus kalcium szint vezet a kötődés troponin-C, és a konformációs változások a fehérjemolekula. Ennek eredményeként ezek a változások tropomiozinnal elmozdul a miozin-kötő hely a aktin és a miozin képes kölcsönhatásba lépni az aktin és genernirovat erőfeszítést mechanokémiai ciklust.
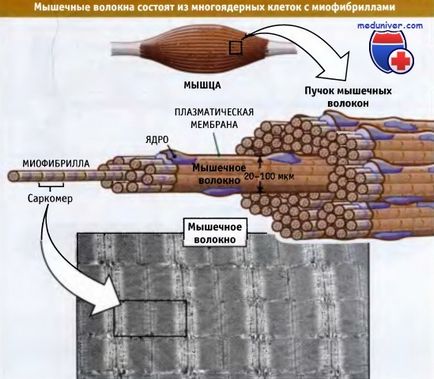
Miofibrillumok képesek csökkenteni és ismétlődő egységeket tartalmazzák az úgynevezett szarkomer.
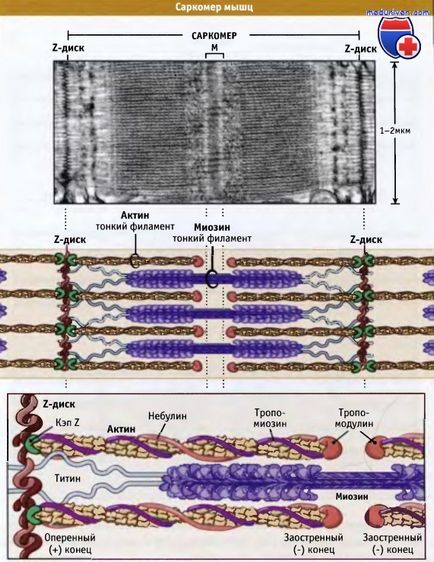
Vastag miozin szálak össze vannak kötve a Z-lemezt, és a protein-Titinius szőtt közötti aktin filmentami.
Nebulin fut Z-lemez Tropomodulin. Azonban, ahogy kötődik aktin, ez még nem ismert.
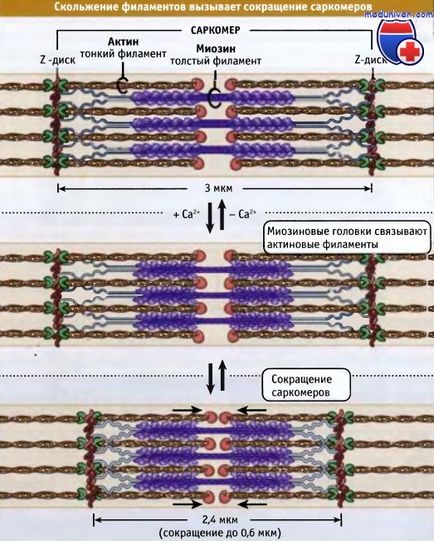
hogy a Z-meghajtók képest el vannak tolva egymáshoz. Ebben csökken A hossz.
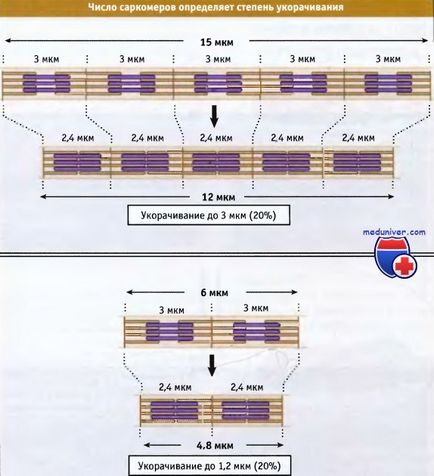
Azonban a százalékos érték a zsiradék nem függ száma szarkomer.
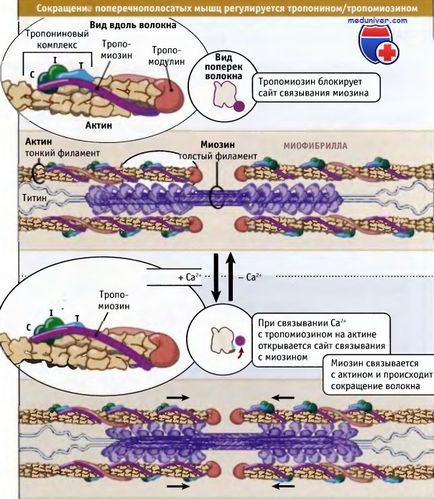
amely meghatározza a helyzetét a komplex troponin / tropomiozin viszonylag miozin és aktin.