Tárgy №4 «elektronegativitása, oxidációs állapota és vegyértéke a kémiai elemek”
tartalomjegyzék
elektronegativitási
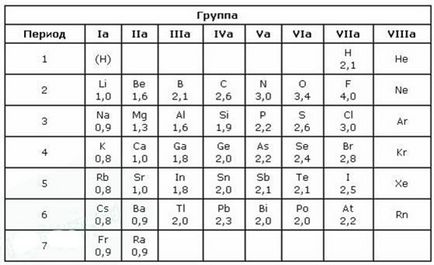
A kémia széles körben használják fogalmát elektronegativitási (EO) - tulajdonát atomok az elem, hogy késleltesse az elektronok az atomok más elemek a vegyületek említett elektronegativitási. Elektronegativitás lítium hagyományosan venni, mint egy egység, EO más elemek kiszámítása rendre. Van egy sor elemek értékei EO.
Számértékek EO tagjai hozzávetőleges: ez egy dimenzió nélküli mennyiség. Minél magasabb az EO elem, a világosabb megnyilvánulhat a fémes tulajdonságokat. EA elemek felírható a következőképpen:
F> O> Cl> Br> S> P> C> H> Si> Al> Mg> Ca> Na> K> Cs

A legmagasabb érték az EA jelentése fluoratom. Értékek összehasonlításával Franciaország EA elemek (0,86) a fluorid (4.1) könnyű észrevenni, hogy engedelmeskedik EO periodikus törvény. Az EO periódusos rendszerének elemei az időszakban növekszik a növekvő atomi száma (balra) és a nagyobb alcsoportba - csökkenés (lefelé). Azokban az időszakokban, növekedése a felelős a atommagok elektronok száma a legkülső réteg megnő, atomrádiusz csökken, így a könnyű visszarúgás elektronok csökken, növeli EO ezért amplifikált nemfémes tulajdonságait.
A különbség a electronegativities elemek a vegyületet (AX) lehetővé teszik, hogy megítélni, hogy milyen típusú kémiai kötés.
Ha az érték Δ X = 0 - kovalens kötés nem poláros.
Amikor a elektronegativitási különbség 2,0 kovalens kötés az úgynevezett poláris. például: a kapcsolat a molekulában hidrogén-fluorid HF HF: Δ X = (3,98 - 2,20) = 1,78
Mivel a különbség elektronegativitási nagyobb, mint 2,0 minősülnek ionos. Például: a link kapcsolatban NaCl NaCl: Δ X = (3,16 - 0,93) = 2,23.
Elektronegativitás távolságtól függ a mag és vegyérték elektronok, és milyen közel a vegyérték héj befejeződött. A kisebb atomi sugár és a magasabb vegyérték elektronok, annál nagyobb a EO.
A fluor a leginkább elektronegatív elem. Először is, azt a elektron vegyértéke héj 7 (hiányzik minden oktett fel az 1 st elektron), és másrészt, hogy a vegyérték Shell közel helyezkedik el a sejtmagba.
Elektronegativitás lehet számszerűsíteni és épít elemek egy sor annak emelkedő. A leggyakrabban használt skálán electronegativities, javasolt az amerikai kémikus L. Pauling.
oxidáció mértékét
Kompozit anyag, amely két kémiai elemek, úgynevezett bináris (bi lat -. Két), vagy egy két elem (NaCl, HCl). Abban az esetben, ionos kötést tartalmaz NaCl nátrium-atom közvetíti a külső elektronsugarak atom klór és transzformáljuk egy ion egy felelős +1, és a klóratom közül elfogad egy elektron, és átalakítjuk egy ion töltése -1. Vázlatosan, a folyamat átalakításának az atomokkal ionok lehet az alábbi képlettel ábrázolható:
A kémiai reakció a molekula HCI összesen elektronpár eltolódik elektronegatívabb atommal. .. Például ,, vagyis elektron sem teljesen áttérést a hidrogénatom, hogy egy atom a klórt, és részben, ezáltal résztöltést atomok δ: H Cl 0,18 -0,18. Ha jelen van, mint egy HCI-molekula, mint a klorid NaCl, elektron teljesen átment a hidrogénatom, hogy egy atom a klór, kapnának egy felelős +1 és -1:
Az ilyen körülményeket ezt nevezik töltés-WIDE oxidációt. Annak megállapítására, ez a koncepció feltételesen azt sugallják, hogy kovalens kötéssel a poláris vegyület-vezetőképes elektronok teljesen átkapcsol az elektron-trootritsatelnomu atom, és így a vegyületek, amelyek-állvány csak a pozitív és negatív töltésű atomok.
Az oxidáció mértéke - a kondicionált töltés egy kémiai elem atomok a vegyület, a feltevéssel számítjuk ki, hogy az összes kapcsolat (és az ionos és kovalens-poláris) kizárólag az alábbiak ionok. Az oxidáció mértéke lehet negatív, pozitív vagy nulla, amelyet általában fölé a szimbólum elem felülről, például:
A negatív érték oxidációs azok atomok, amelyek által hozott elektronok vagy más atomokkal, amelyekhez megosztott elektronpár vannak tolva, azaz. E. Az atomok elektronegatívabb elemek. A pozitív érték az oxidációs azok alkilcsoport, amely feladja elektront egy másik atommal vagy amelyeket levonni a közös elektronpár, azaz. E. kevésbé elektronegatív atom elemek. A nulla érték oxidációs állapotban lévő atom a molekulák és atomok egyszerű anyagok szabad állapotban, például:
A vegyületek a teljes oxidáció mértéke mindig nulla.

vegyérték
Kémiai vegyérték atomja elsősorban úgy határoztuk meg a számát párosítatlan elektront részt vevő kémiai kötéssel.
Valence lehetőségeit atomok határozzák:
• száma párosítatlan elektronok (egy-elektron pályák);
• a jelenlévő szabad pályák;
• jelenléte nem megosztott elektron pár.
A szerves kémia, a „vegyértéke” helyettesíti az „oxidációs fok”, amely szokásosan működnek szervetlen kémia. Azonban ez nem ugyanaz a dolog. Vegyérték nem jelöli, és nem lehet nulla, míg az oxidáció mértéke szükséges és jellemzett jel lehet értéke nulla.
Általában, a vegyértékű képességére utal atomok alkotnak egy bizonyos számú kovalens kötés. Ha az atom van párosítatlan elektronok n és m osztatlan elektron pár, ez az atom képezhet N + m kovalens kötést létesíteni más atomokkai, azaz ez egyenlő a vegyértéke n + m. Annak megítélésekor, a maximális vegyértéke kell alapulnia elektronikus konfigurációja „gerjesztett” állapotban. Például, a maximális atomi vegyértéke a berillium, bór és nitrogén 4.
- H, Na, Li, K, Rb, Cs - Oxidációs I
- O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd - II oxidációs
- B, Al, Ga, In - Oxidációs III
Használata vegyértékek képezhet képletű vegyületetek.
Kémiai képlet - Feltételes felvétel esetén a anyagösszetétel révén kémiai szimbólumok és indexek.
Például: H2 O-általános képletű vízben, ahol H és O-kémiai jelek elemek 2 - index, ami azt jelzi, az atomok számát egy elem tartozó vízmolekula.
Amikor az anyagok nevét, változó vegyértékű fel kell tüntetni annak a vegyérték, amely kerül zárójelbe. Például, P2 05 - foszfor-oxid (V)
I. Az oxidáció mértéke a szabad atomok a molekulák és atomok egyszerű anyagok nulyu- Na0, P40, D2 0
II. A komplex anyag algebrai összege valamennyi atom a CO tekintetében a mutatók nulla = 0, és a komplex ion annak ellenében.
Nézzük például a több kapcsolatot és elismerik vegyérték klór:
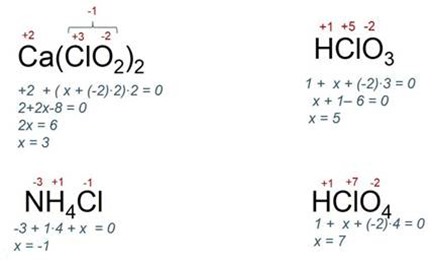

Háttér vizsgálati anyagot:

