Raoult-törvény
A híg oldatok Raoult-törvény az alábbiak szerint történik: telített gőz nyomása az oldószer oldatot (P1) arányos a móltörtje oldószer az oldatban (N1):
ahol P10 - gőznyomás felett a tiszta oldószert.
Az oldatok elkövetett egyes komponensek engedelmeskedik Raoult-törvény, amely ebben az esetben van írva a következő:
ahol
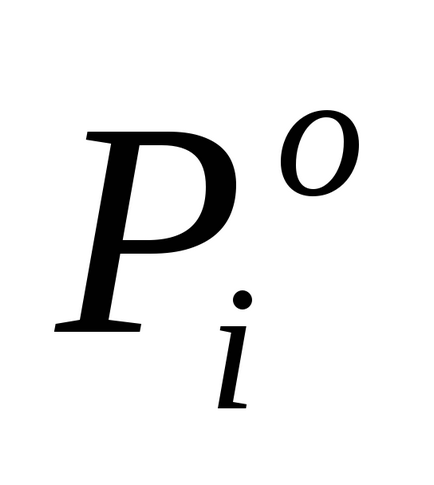
Ebben az esetben, a teljes gőznyomás felett a megoldás összegével egyenlő a parciális nyomások gőz az oldat komponenseinek:
Raoult egyenlet, amely figyelembe veszi a disszociációs az oldott anyag híg oldatok, a formája:
ahol i - izotóniás van't Hoff faktor jelzi, hogy hányszor növeli a részecskék száma az oldatban disszociációja miatt, és a kapcsolódó a disszociációs mértéke az α az alábbi összefüggés:
ahol ν- részecskék száma, amelybe a molekula disszociált oldatban.
Attól függően, hogy növekedjen a forráspont (. ΔTkip = T - Tokip.), És az alacsonyabb a fagyasztási hőmérséklet (T ΔTzam = Tozam.-.) Híg oldatainak a koncentrációt az oldatok által kifejezett következő egyenletek anyagokra nedissotsiiruyuschih
és az egyenletek disszociáló anyagok
Amennyiben Tokip. Tozam. - fagyasztás és a forráspontja a tiszta oldószer;
m- molalitás az oldat;
Cab. és Kcr. - ebulioskopicheskaya és oszmométerek állandóit az oldószer, jellegétől függően, és nem függ a természet a oldott anyagok. A megadott értékek állandók adjuk referencia irodalomban.
Emelésével forráspontja (ebulioskopichesky kutatási módszer - ebullioscope), vagy a fagyáspont csökkentő (oszmométerek módszer -krioskopiya Research) hígított oldatokat lehet kiszámítani rastvorovm koncentrációt. izotóniás koeffitsienti. a disszociációs mértéke oldott veschestvaα és tekintettel arra, hogy a molalitás adja (2,5), annak moláris massuM2:
Példa Példa 2.2. A nyomás a telített vízgőz az oldat felett nem illékony anyagok vízben 2% alatt van gőznyomása felett tiszta víz. Határozza meg a molalitás az oldat. A moláris tömege M1 víz = 18 g / mol.
R e w n e
Találunk móltörtje oldott anyag az oldatban, amelyhez használjuk a Raoult törvény egyenlet (2.7):
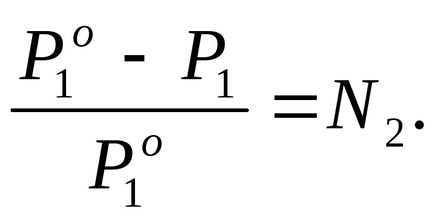
Nyilatkozata szerint a probléma P1 2% -kal alacsonyabb
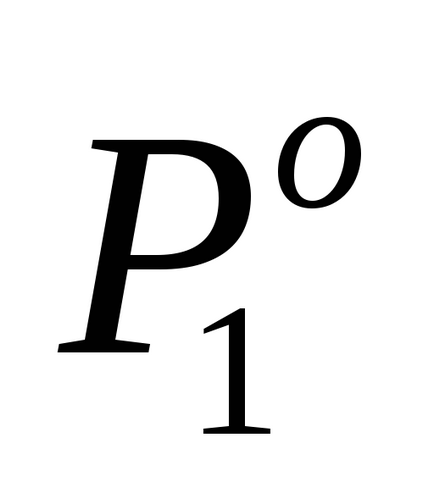
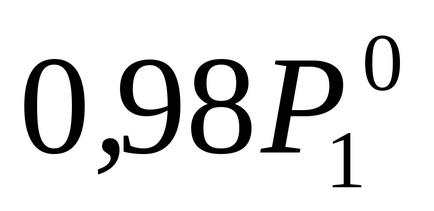
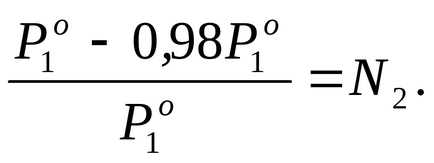
Ahhoz, hogy meghatározzuk a molalitás m kiszámítja a mólszáma oldott veschestvan2. csökkenő oldatban 1000 g vízben. Ez sluchaem = n2.
A móljainak száma vízzel 1000 g értéke:
Összhangban a meghatározás (2.2) írhatunk kifejezés a móltörtjét oldott:
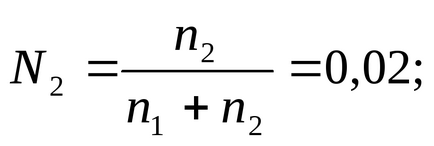
amelyben helyettesíti az érték n1. helyett n2-m. és találja meg a következőket:
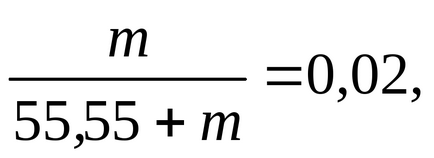
m = 1,134 mol / 1000 g víz.
Példa Példa 2.3. Számítsuk ki a teljes gőznyomás felett bináris tökéletes megoldás hőmérsékleten 313 K, amely 200 g diklór-etán C2H4Cl2 (EDC) és 350 g benzolaC6H6 (B). ha a gőznyomása ezek a tiszta anyagok ezen a hőmérsékleten a következők: RoDHE = 2,066 × 10 4 Pa, és a
Találunk mólszámainak a komponensek a megoldás:
az összes móljainak száma anyagok:
Számítsuk ki a móltörtje az egyes komponensek az oldatban:
Gőznyomás az oldat felett az egyes komponensek által Raoult törvénye egyenlet tökéletes oldatok (2.7):
A teljes nyomást egyenlet szerint számítjuk ki (2.8):
Példa Példa 2.4. Számítsuk ki a fagyáspont (kristályosítás) 1% S-oldat kéntartalmának Fe vasat. Ha a kristályosodás hőmérséklete a tiszta vas 1813 K, és annak Kcr. = 101,5 K / mol. Kén moláris tömege 32 g / mol.
Amennyiben az oldat tartalmaz 1%, az oldott anyag 100 g ilyen oldat 1 g kén és 99 g g2 g1 vas. Számítsuk ki a molalitás oldatot kén vasban egyenlet szerint (2.5):
Süllyesztése fagyáspont közelítő egyenlet (2.12):
A fagyasztás hőmérsékletét oldott kén vas:
Példa Példa 2.5. Számítsuk ki, hogy mennyi etilén-C2H4 (OH) 2, hogy hozzá kell adni 500 g vizet g1. hogy alacsonyabb a fagyáspont az oldat 3 fok. Oszmométerek állandó Kcr vizet. = 1,86 ° / mol. Móltömeg M2 etilén = 62 g / mol.
Megtaláljuk a molalitás az egyenlet megoldása (2.15):
Tól képletű (2,5) kiszámítására a molalitás:
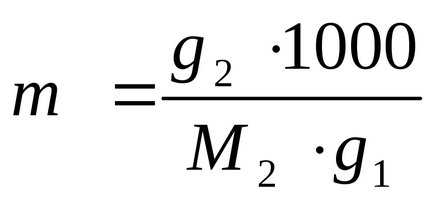
Fejezzük és elvárják érték g2:
Példa Példa 2.6. Számítsuk ki a moláris tömege az anyag, ha a fagyasztási hőmérséklet tartalmazó oldat 200 g benzol és 0,4 g g1 analit g2. 0,17 K fagyáspontja alatti benzol. Oszmométerek állandó Kcr benzolt. = 5, 16 K / mol.
Számítás a következő képlet segítségével (2.18) a oszmométerek:
Példa Példa 2.7. Számítsuk ki a látszólagos disszociációs fokú BaCl2 só 3,2% -os vizes oldat, ha a forráspontja a vizes oldat egyenlő 100,21 C móltömege bárium-klorid 208 g / mol. Ebulioskopicheskaya állandó Cab vizet. = 0,512 fok / mol.
Definiáljuk a molalitás az oldat a következő képlet szerint:
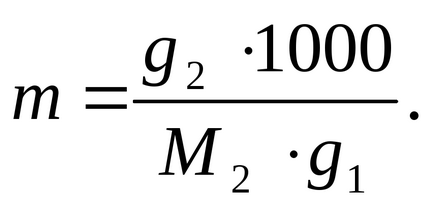
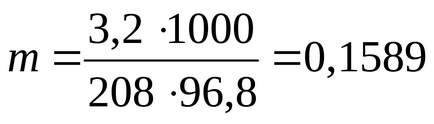
ahol a 100 ° C - a forráspontja a tiszta oldószer (víz).
Mi található a van't Hoff faktor egyenlet (2.17):
.
A disszociációs mértéke α megtalálható a kapcsolatban (2,10)
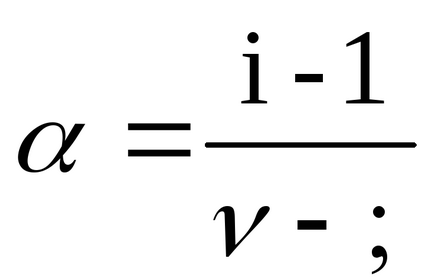
a BaCl2ν = 3, mivel a disszociációja egyetlen molekula só képződik három ion;
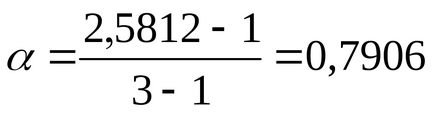
A kapott disszociációs mértéke az erős elektrolit a látszólagos és valós közel szerinti 1 Arrhenius elmélet.