Alapjai elektrokémia - studopediya
Amikor elmerül fémlemez szabadon az oxidfilm elektrolit oldatban a fém - elektrolit oldat elektromos kettősréteg (EDL), azzal jellemezve, hogy egy bizonyos potenciális különbség, vagy egy bizonyos elektród potenciálja.
DESvoznikaet kapott töltött részecskék mozoghat a két fém között fázishatár (M), a szilárd fázis (t) - Elektrolit oldat (g). Kialakítása során, például, abban az esetben a fémlemezek, vízbe merülő, a következő folyamatok történnek:
1. A szétválasztása pozitív töltésű ionok (kationok) a fémfelület és átmenet az oldatba.
2. A felesleges elektronokat maradt a fém, a felületi töltése negatív.
3. hidratálás kationok poláros vízmolekulák az ömlesztett folyékony fázisban (szolvatációs oldószer-molekulák)
M + nH O → M · nH O
A fent említett folyamatok (1,2,3) fenn egyidejűleg, és ezért az általános egyenlet felírható a:
4. Koncentráció hidratált (szolvatált) kationok a folyékony fém mellett a felületi réteg miatt kölcsönhatás negatív töltésű felületét. A pozitív töltésű kationok vonzódnak a negatív töltésű felületét. DPP képződik, azzal jellemezve, elektród potenciálját.
5. A növekvő potenciális ugrás a fém és az elektrolit oldat, amely magasabb még elkezd folyni a fordított folyamat, kiszáradás a fémionok és azok ezt követő redukálására az atomok.
6. Ha egy potenciális ugrás egyensúly bekövetkezik:
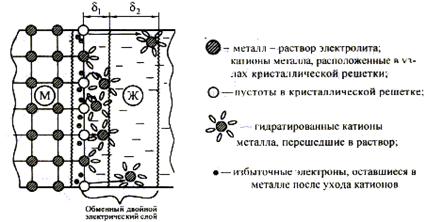
Ábra. 12. Az áramkör a előfordulása cseréjét a villamos kettős réteg, és az elektróda potenciál a fém-elektrolit oldat.
A egyensúlyi potenciálja az elektród (vagy az elektróda potenciál) - a között létrejövő potenciálkülönbség a fém elektrolit oldat egyensúlyi.
A nagysága elektród potenciál, és a villamos kettős réteg vastagsága függ a fém természetétől, a hőmérséklet és az aktivitás (koncentráció) ionok oldatban. DES van egy diffúz szerkezetű, így lehetetlen meghatározni a abszolút értéke az elektród potenciál. Azonban, ha az általunk használt a referencia elektród, amely a potenciális hagyományosan nullának (E1 = 0 (V)), akkor ki lehet számítani a ismeretlen félcella potenciálok az elektróda (E2) viszonyítva a referencia elektród segítségével az egyenlet: EMF (DE) = E1 - E2.
A gyakorlatban, használja a relatív (névleges) értéke az egyensúlyi potenciálja. címkézés.
Relatív standardpotenciál - egyenlő a nagysága az elektromotoros erő egy elektrokémiai cella, amely egy elektróda esett egy oldatot fémionok aktivitással egyenlő 1 mol / liter, 25 0 C-on (298 K), ha P = 3.1.10 5 Pa, és a referencia elektród.
Mivel a referencia elektród segítségével a standard hidrogén elektród (2. ábra). Szerkezetileg ez áll egy platina lemez (bevonva egy réteg elektrolitikus platina - platinakorom) részben elárasztott tartalmazó oldatban hidrogén-ionokat (tipikusan H2 SO4 vagy HCI oldat). Ahhoz, hogy a lemezt etetett tiszta hidrogén gáz állandó nyomás alatt. A savas közegben a hidrogén-elektród H3 O + / H2. Pt elektród folyamat kielégíti a következő egyenlet 2H3 O + (x) +2 H2 (T) + 2H2 O (g). van írva a egyszerűsített formában: 2 H + (x) +2 H2 (T).
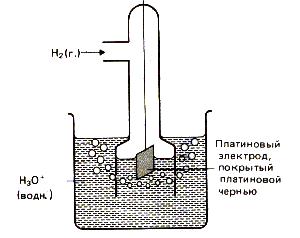
13. ábra. Hidrogén elektród.
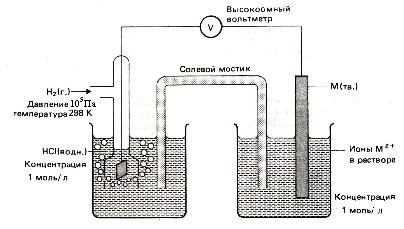
14. ábra. Mérése standardpotenciál
A vázlatos belépési hidrogén elektród a következők: ha az anód platina vagy
, ha a platina a katód.
Hidrogén használatával elektród lehetővé teszi, hogy mérjük a relatív potenciálját minden egyes elektród a fele elemet képezve vele kémiai áramgenerátort (3. ábra).
Ha hidrogén-elektród működik a negatív elektród, vázlatos bejegyzés így alkotott kémiai áramforrás a formája: A - PtêH2 (g) êH + (f) êêM n + (w) êM (t) + K. ezért
Ha hidrogén-elektród viselkedik, mint egy pozitív elektródot. A - M (t) êM n + (w) êê H + (f) ê H2 (g) ê Pt + K. akkor.
Így a standardpotenciál a félcella megfontolás alatt egyenlő a standard EMF kémiai forrás, amely ebből a félcella és standard hidrogén elektród.
A szokatlan körülmények között, az elektród potenciál kiszámítása a Nernst-egyenlet:
(RP) - oxidált formában;
(WF) - redukált formáját;
R = 8,314 J / K. mol (egyetemes gázállandó);
E 0 relatív standard elektródpotenciál (táblázat adatai); mért V (V);
T az abszolút hőmérséklet (298 K);
F-Faraday szám egyenlő 96500 (C / mol);
n-elektronok száma a folyamatban részt vevő;
C-moláris koncentrációja fémkationok (mol / l).
E = E 0 + 0,059 / n. lgCMe n +, ha CMe n + = 1 mol / l, akkor E = E 0.
Feladat. Számítsuk ki az elektród potenciálját arany lemez, leengedjük a sóoldat koncentrációjának [Au 3+], egyenlő 0,1 mol / l.
Mivel a leírt feltételek a problémát, eltérő szabvány szerint, vagyis, Sau 3+ ¹1 mol / l és 0,1 mól / l a feltétele a problémát, tehát, hogy kiszámítja a elektródpotenciál használatához szükséges a Nernst-egyenlet:
A koncepció a standardpotenciál be annak érdekében, hogy össze lehessen hasonlítani a redox tulajdonságait a különböző rendszerek által szabványos lehetőségeit.
Összhangban az értékeket a standardpotenciál készült, az elektrokémiai sorban a fémek feszültségek.
K Ca mg Al Zn Fe Pb H + Cu Ag Au
1. Minden fémek Burkolólapok maradt hidrogén. negatív standardpotenciál. a jogot, pozitívan állnak a potenciális .Soglashenie jelek készült 1953-ban. A kongresszuson az IUPAC (IUPAC). Megállapodtak abban, hogy tulajdonítani, hogy az adott jel. amelynek van egy olyan elektródája párosítva a standard hidrogén elektród.
2. A negatív értékek azt jelzik, hogy ezek a fémek tekintetében redukáló a hidrogénatom, azaz préselt (csökkent annak ásványi savval megoldások c = 1 mol / l, az anionjai, amelyek nem mutatnak oxidáló tulajdonságokkal (HCI. razb.H SO))
Zn + 2 HCI → ZnCI + H ↑; E 0 Zn n + / Zn = -0,763 B
és vízzel elbontjuk
3. A több negatív elektród potenciál érték, annál nagyobb az a képessége, hogy a fémionokat oldatban, azaz az erősebb redukáló fejezzük redukált formában (a képesség, hogy adományozni elektron), és az alábbiakban annak oxidáló képessége az oxidált forma (a képesség, hogy elfogadja elektronokat).
4.Polozhitelnoe kapacitás érték azt jelenti, hogy az adatokat fémionok oxidáló tekintetében hidrogénatom, azaz nem bomlanak, és a víz nem szorít ki megoldásokat, amelyben = 1 mol / l. Ezzel szemben, a hidrogén kiszorítja fémek oldataiból sóik.
5. között a fém pozitív standardpotenciál, minden egyes korábbi fém kiszorítja az összes ezt követő oldatai sóik. Például: Cu + HgCl2 → CuCl2 + Hg.