Elektrolitos disszociáció iránymutatások laboratóriumi munka
1 Cél
A cél az, hogy tanulmányozza a természete disszociációs és ch-cal aktivitását különböző elektrolitok, meghatározására irányba-MENT reakciókat oldatok elektrolitokat, kutatás feltételei Dropped Denia kicsapás és oldódási.
2 Fő elméleti felvetéseket
2.1 Erős és gyenge elektrolitok. Állandó és disszociációfok
Az elektrolitok olyan anyagok, oldatok vagy olvadékok, amelyek vezetik az elektromos áramot.
Jelenlegi vektor elektrolit oldatok ionok vannak kialakítva disszociációja az oldott anyag.
Elektrolitikus disszociációs nevezzük bomlási ionos vagy poláros vegyületek ionokra hatása alatt a poláris molekulái Mondd-coff.
A képesség, hogy disszociációs valamennyi anyagok két csoportra oszthatók: az egyik tartalmazza azokat az anyagokat, amelyek az oldatban disszociálnak teljesen vagy majdnem teljesen; egy másik csoport magában foglalja anyagok disszociáló részben.
Olyan anyagok, amelyek szinte teljesen disszociál ionokra, a továbbiakban erős elektrolitok.
Olyan anyagok, amelyek szétesnek megoldás nem teljesen nevezzük gyenge elektrolitok. Oldatokban gyenge elektrolitok Mi létre JELÖLI-közötti dinamikus egyensúlyt disszociálatlan molekula ionok és E:
Ez az egyensúly jellemzi mennyiségileg állandó egyenlő-egyensúlyt, ami kapcsolatban a disszociációs állandója a disszociációs folyamat nevezik:
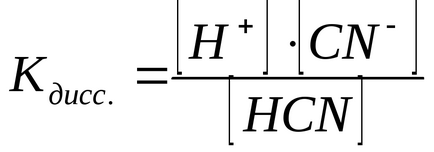
A disszociációs állandója az elektrolit nem függ az oldat koncentrációja, de függ a hőmérséklettől, és a természet az oldott anyag és az oldószer. Minél alacsonyabb az érték az állandó, a gyengébb az elektrolit.
Így az alapvető különbség a két típus között az elektrolitok visszafordíthatatlan disszociációja erős elektrolitok és visszafordíthatósága disszociációja gyenge elektrolitok.
A mennyiségi jellemző elektrolit ionok képesek lebontani a disszociációs mértéke - . A disszociációs mértéke elektrolit aránya számát a molekulák az oldatban szuvas, hogy ionok az elektrolit a teljes száma molekulák oldatban. A disszociációs mértéke az elektrolit 0,1 n. oldatot veszünk mint kritérium hozzárendelése az elektrolit a csoport erős vagy gyenge elektrolitok erős elektrolitok > 0,3, gyenge elektrolitok ≤ 0,03.
Ami a vizes oldatok erős elektrolitok:
- A Erőteljes bázis: az alkálifémek hidroxidjai és az alkáli földfémek:
- A legtöbb oldható sók. Kivételek: Fe (SCN) 3. Mg (CN) 2. HgCl2. Hg (CN) 2, és mások.
Gyenge elektrolitok közé:
- A gyenge bázis és amfoter fém-hidroxidok: Be (OH) 2. Mg (OH) 2. Fe (OH) 2. Zn (OH) 2. Ammónium-hidroxid NH4OH, és a szerves bázisok - amin (CH3 NH2) és az amfolitokat (H3 N + CH2 COO -);
- nagyon gyenge elektrolit vizet (H2 O), = 2 · 10 -9.
Ha elektrolit ACh disszociáló a ionok A + és X -. állandó, és a disszociációfok kapcsolatos törvény (hígítás)
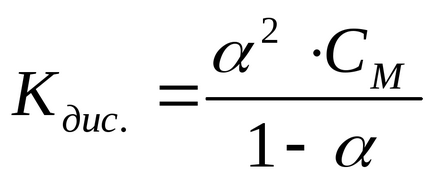
Lásd - moláris koncentrációja az elektrolit, mól / liter.
Ha a disszociációfok lényegesen kisebb, mint egy, akkor meg tudjuk venni a közelítő számítás, hogy az 1 -

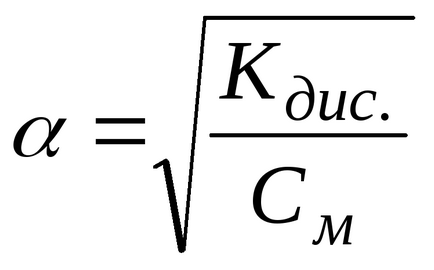
Az utóbbi arány azt jelzi, hogy a hígító oldat, azaz csökkenő elektrolit koncentráció (CM), a disszociációs mértéke az elektrolit növekszik.