Egyszerű kapcsolat shpulkin 1984 g
könnyen csatlakoztatható
A legegyszerűbb szerves vegyület - a metán. A molekula áll öt atom - egy szénatomot és négy hidrogénatomot egyenletesen vannak elosztva a tér körül a központi szénatom. Itt állunk szemben elsősorban a fő vonalaival szerves kémia - minden töltetlen szerves molekulák szén négy vegyértékű mindig. Grafikusan, ezt tükrözi az a tény, hogy meg kell párosul kémiai szimbólumok vagy más elemei ugyanazt a négy szénatom kötőjel. A metán mind a négy hidrogénatom van egyenlő távolságra egy szénatom és egy maximális távolság egymástól térben.
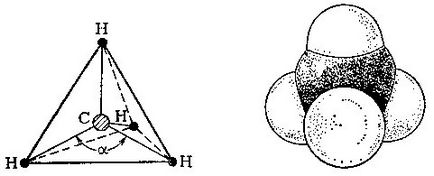
Egy molekula metán szénatom van a közepén egy szabályos tetraéder, és négy hidrogénatomot - annak csúcsait.
Úgy néz ki, mint a metán-molekulát atomok mérete.
Ahhoz, hogy épít egy modellt a molekula, hogy egy tetraéder, t. E. A helyes tetraéder álló egyenlő oldalú háromszög, és tegye azt a közepén egy szénatom. A hidrogénatomok lesz található a csúcsai a tetraéder. Csatlakoztassa az összes hidrogént, hogy a központi szénatomhoz. szög # 945; két ilyen sorok lesznek 109 fok és 28 perc alatt.
Tehát épített modell a metán. De mi van a molekula mérete a valóságban? Az utóbbi évtizedekben, a segítségével fizikai módszerekkel kutatási (róluk később), akkor lehetséges, hogy pontosan meghatározzuk a atomközi távolságok a molekulák a szerves vegyületek. Egy molekula metán központjai közötti távolság a szénatomon és bármelyik hidrogénatom jelentése 0,109 nm (1 nanométer, nm = 10 -9 m). Annak érdekében, hogy szemléltesse, hogyan néz ki molekula a térben, és élvezze a modellek Stewart - Brigleba, amelyben az atomok által képviselt golyó sugara.
Most fogjuk fel ezt a kérdést: milyen erők kötődnek tartalmaznak a molekulában, a szerves vegyület, ezért a hidrogén-atomok nem távolítható el a szén-dioxid-központ?
szénatom áll, egy pozitív töltésű mag (a díj egyenlő 6), és a hat elektronok elfoglaló különböző * pályákat körülvevő nucleus, amelyek mindegyike megfelel egy bizonyos energia szintet.
* (Orbital lehet tekinteni, mint egy régióban a tér, amelyben valószínűleg megfelel a legtöbb elektron)
Két elektron elfoglalják a legalacsonyabb legközelebb a mag orbitális. Ezek mind hatnak erősebben „saját” nucleus és részt vesznek a kémiai kötések jönnek nem fogadja el. Más üzleti - fennmaradó négy elektronokat. Vegye figyelembe, hogy az úgynevezett gerjesztett szénatom, azaz, egy külön atom, nem képezik kötést létesíteni más atomokkai, ezek az elektronok vannak elrendezve a következők: .., két az alsó alréteg és két s magasabb alréteg p. Némileg egyszerűsödött, és sematikusan az akkor feltételezhetjük, hogy a felhő, hogy képezi a elektron s -podurovne, van egy gömb alakú. Felhők p elektronok tűnik terjedelmes nyolcas, a nyolc lehet elhelyezni a térben tengelyek mentén az x, y és z. Ennek megfelelően, minden egyes atom három p pályák: px. Py és pz. Ily módon minden orbitális egy atom egy határozott alakú, és található egy különleges módon a térben.
Annak érdekében, hogy érintkezésbe kerüljenek más atomokkal kémiai kötéseket velük, szénatommal kell először megy különösen a gerjesztett állapotban. Ebben egy elektron orbitális komló s o orbitális. Ennek eredményeként az egyik elektron foglal gömb s orbitális és a fennmaradó három elektronok formájában három-nyolcas pályák. Ez a helyzet azonban atom energetikailag kedvezőtlen. Egy kisebb energia atomi pályák megfelelnek az négy azonos, szimmetrikusan elrendezett térben. Ezért van egy keverő, homogenizálási vagy, mint mondják, hibridizációja pályák hozzáférhető. és ennek eredményeként kapjuk négy új azonos pályák.
Ezek a hibrid pályák is hasonló a nyolc, de a nyolc-oldalú: az elektronsűrűség szinte teljesen eltolódott az egyik oldalon. Az ilyen sp hibridizált pályák kijelölt 3 (az elektronok száma különböző, nem-hibrid pályák részt vesz a kialakulását: az egyik s orbitális és három - p pályák).
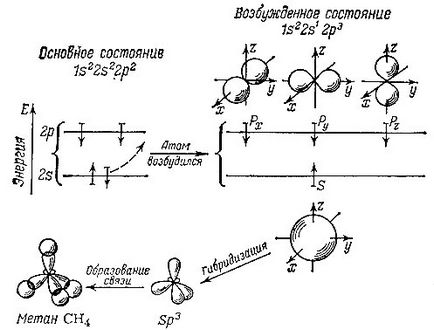
Ott látható vázlatosan hibridizáció a kialakulását a metán molekula. A nyilak jelzik a viszonylagos irányát az elektron forog
Mivel a metán molekula elrendezve? Mind a négy hibrid pályák a szénatomok, amelyek célja különböző irányokban (vagy inkább, a sarkokban egy képzeletbeli tetraéder, melynek szerkezete körül), illeszkedés hidrogének N. atom vodoroda- ezt a magot egy felelős 1 (a közönséges fény izotóp hidrogén - egy proton), és egy elektron foglal egy gömb alakú orbitális körül a proton. Felhők „szén” és a „hidrogén” elektronok átfedik egymást, és ez azt jelenti, a kialakított kémiai kötésen. Minél nagyobb az átfedés az elektron felhők különböző atomok, annál erősebb a kötés. Most világossá válik, hogy miért a hibridizált pályák nyereséges -, mivel az ilyen egyoldalú, kiálló egyik oldalán nyolc lehet sokkal több átfedés az elektron felhő a hidrogén, a kevésbé kiterjedt a térben nem hibrid pályák. Vegye figyelembe, hogy ezek az érvek kissé önkényes: tiszta, hogy úgy mondjam, az egységes és gerjesztett szénatom nem létezik igazán. Ezért nincs értelme, hogy megvitassák, hogyan is történik meg ezek az átalakulások a pályák, az úgynevezett hibridizáció. Azonban, a leírás egyszerűsítése a kémiai kötések révén képletek és számok, az ilyen egyezmények hasznos. Mi ebben a nem újra, hogy ellenőrizze.
Hogyan juthat el a metán?
Az egyik legegyszerűbb módja - víz hatása alumínium-karbid:
Azonban, alumínium-karbid - a drága kiindulási anyagból az ilyen hagyományos, alacsony költségű termékek, mint például a metán, és a fogadó azt más vegyületek nem szükséges - földgáz áll 85-98% metán.
Metán - egyik alapvető „építőkockák”, amely a konstrukció szerves vegyületek. Mik ezek a vegyületek, és hogyan lehet őket a metán?
Valójában, a metán - az anyag viszonylag inert, és egy sor kémiai reakciók, amelyek lehet tenni kicsi vele.
Vegyünk egy keveréke két gáz - metán és klór és tegyük egy üvegedénybe. Ha ezt a hajót tartották a sötétben, nem észleltünk reakciót. De megpróbáljuk kiemelni a palackot napfénynek.
Quant fény kölcsönhatásba lép klórmolekula, kapott molekula két részre tagolódik - két klóratom:
A kapott atomok sokkal aktív molekulák, azonnal megtámadják a metán molekulák és elfog hidrogénatomok. Ebben a formában a hidrogén-klorid-HCI molekulák nagyon instabilak, és nagyon reaktív, úgynevezett metil gyökök # 8901; CH3.
Metilcsoport továbbiakban „szétválasztja” a klór-molekula:
Az eredmény már ismert klóratom (könnyen megjósolni a jövőbeli sorsa: megtámadja új metán molekulák és az összes ismétlődések), és a klór-metán, metilén-klorid, vagy - a metán-származék, ahol az egyik hidrogénatomja klór-.
A reakció, amely azt mondták kategóriájába tartozik az úgynevezett láncreakciót. amelyben minden szakaszában, mint a, és az előző és az azt követő lánc. Aktív részecskék - a termék egy lépésben (itt, klóratommal és metil- gyökök # 8901; CH3) használó a következő lépésben, mint a kiindulási anyagok. A felfedezés a láncreakció volt az egyik fő eseménye a kémia, és akadémikus NN Semenov és angol tudós SN Hiishelvud az ő hozzájárulása a tanulmány az ilyen reakciók és az ezekre vonatkozó elméletek kapta a Nobel-díjat.
Ha a reakció az, hogy vezessenek be olyan mennyiségű reagensek egyike klórmolekula volt két molekula metán, általában, megkapjuk a metil-klorid CH3 Cl. Ha vesszük a klór feleslegben, a szubsztitúciós reakció megy tovább, és ezen kívül, hogy a metil-klorid, metilén-klorid is CH 2Cl 2. kloroformban CHCI3, és végül, a termék teljes helyettesítése hidrogén klórral, szén-tetraklorid CCl4.
De ne felejtsük el, a mi feladatunk: építeni a különböző komplex molekulák egyszerű építőkövei metán molekulák. Ehhez szükségünk van a metil-klorid. Ha a hatása a vegyület nátrium-fém, akkor minden két molekula CH3 Cl-etán képződik egy molekula, amelyben szén kötés - szén:
Mi etán? Ez a metán, amelyben az egyik hidrogénatom helyett metilcsoport # 8901; CH3. És ez nagyon radikális, mint már tudjuk, kapjuk a szétválasztása metán hidrogénatom.
Ha most az etán helyére egy hidrogénatomja (bármely atom), a metil-, akkor megkapjuk egy új anyag - Propán CH3-CH2-CH3. Hogy ez lehet tenni a gyakorlatban, tudjuk: az első, a metán és az etán cserélje egy hidrogénatom klór-, majd cselekedni egy-metil- és etil-klorid, nátrium-(ez a reakció az úgynevezett Wurtz reakció után a francia vegyész, aki fedezte fel):
Gyerünk. Propán helyett az egyik hidrogénatom az klórt. Kiderül, hogy nem minden most egyenlő, ami helyettesíti az atom! Cseréje a hidrogén, a szélsőséges szénatom (két ilyen atom), vagy közepes megkapjuk két különböző vegyület: normál propil- (n -propil-) és izopropil-klorid:
Most cserélje Ezeknek a vegyületeknek mindegyike, a klór atomok a metilcsoportok. Kapunk két különböző bután - normális (azaz nem elágazó ..) bután (n-bután) és az ISO bután:
Jegyszedők egy molekula inkább a „építőkövei”. Először is n-bután. Ott lehet helyettesített egy a szélsőségek metil-hidrogén atomok. Kapjuk normál pentán. Akkor cserélje egy másodlagos hidrogén. Jöttünk, hogy minden -pentanu. Úgy tűnik, az n-bután semmi új, hogy kap. Térjünk át minden -butanu. Ha van cserélje egyik hidrogénatomját extrém (a CH3 -csoportok), eljutunk a már említett ISO -pentanu, és cseréje az átlagos egyetlen hidrogénatom, neopentán kapjuk:
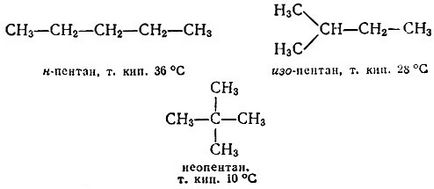
Továbbra is ez a folyamat végtelen. Mindezen vegyületeket nevezzük szénhidrogének (pontosabban - limit, telített szénhidrogének vagy alkánok), mert ezek állnak csak két elem, a szén és hidrogén. Mindenesetre alkán hidrogénatomok számának 2n + 2, ahol n - a szénatomok száma. Ezért, a határ képletű szénhidrogén általában írva, mint: C n + 2 H2N.
Az épület a struktúrákat, azt kell mondanunk, időben megállítani. Az a tény, hogy a számos lehetséges izomerek gyorsan növekszik drasztikusan növekvő számú szénatomot tartalmaznak az alkán molekulában. Tehát, Dean, szénhidrogén C10 H22. 75 különböző lehetséges izomer, a száma szénhidrogén-izomerek a C20 H42 (eikozán) egyenlő 366 319. A számos lehetséges izomerek tetrakontana, szénhidrogén-C40 H82. nehéz elképzelni, hogy 62 491 178 805 831.
Most kiderül, hogy miért ma már tudjuk, számos szerves vegyületek - több millió - és miért ebben a tekintetben, kémia, szerves kémia, szervetlen messze. De még mindig csak beszél a legegyszerűbb képviselői a szerves anyag - telített szénhidrogéneket.
Mi levezethető számos izomer szénhidrogének metánból segítségével a Wurtz reakció. A gyakorlatban azonban, mert nem jön senki. Az a tény, hogy a legegyszerűbb szénhidrogén, együtt metán szereplő földgáz, amelynek összetétele változik a különböző területeken. Például, Észak-Stavropol gázlelőhelyek tartalmazott 85% metánt, körülbelül 5% etán, 2,5% propánt és 1,4% pentán és nehezebb szénhidrogéneket. Gáz Gazlinskogo területén áll metán 98%, etán ott csak 1,6%. Sok szénhidrogén olajban, hanem inkább, hogy - a következő fejezetekben.
Alsó szénhidrogének - metán, etán, propán és bután - színtelen, szagtalan gázok vagy gyenge benzin szag. Szénhidrogének pentánból pentadekán C15 H32 - folyékony, és végül, a magasabb szénhidrogének szobahőmérsékleten - szilárd anyagok.
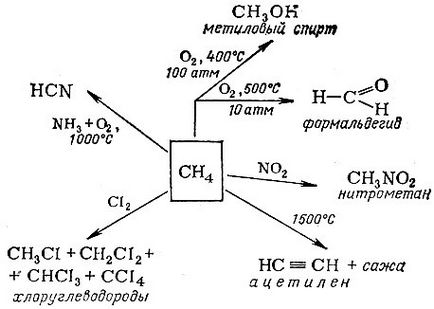
Néhány példa a metán további alkalmazása
Mivel a szénatomok száma növeli a forráspont és olvadó vegyületet.
A telített szénhidrogén egy másik nevet - paraffinok. tükrözve a kémiai semlegesség (latin parum affinis - alacsony affinitású). És mégis széles körben használják a vegyiparban, hogy készítsen a különböző anyagok. A főbb ipari felhasználása metán irányban a rajzon látható.
Mielőtt befejezni beszélünk metán és telített szénhidrogének, a választ egy kérdés: Hogyan a kapcsolat a paraffinok két szénatom közötti, például etán? Ez egyszerű - körül minden szénatom, feltéve, mint a metán, négy sp3 hibridizált pályák, három közülük kommunikálni hidrogénatomok, és az egyik átfedi pontosan ugyanolyan orbitális egy másik szénatomhoz. A kötés hossza a C-C 0,154 nm.