Vivos VOCO GEVO, a vírus belép a sejtbe
Mivel a vírus belép a sejtbe
Yuri Alexandrovich Chizmadzhev, korr. Orosz Tudományos Akadémia, d. X. n. prof. MSU Biofizikai Intézet,
Vezetője Laboratórium Intézet Elektrokémiai bioelectrochemistry im.A.N.Frumkina RAS.
Mint ismeretes, a sejt tartalmaz egy nagyszámú hártyás struktúrák - az izolált vezikulumok egy folytonos hálózatot az endoplazmás retikulum. És az egész rendszer egy állandó átszervezések, amely magában foglalja a többszörös cselekmények fúzió és a hasadási. Tehát, a Golgi-apparátus protein csomagolva tartályokban vezikulumokban biztosíték a plazmamembrán. Ezzel befejeződött a folyamat exocitózisban. Egy másik példa - a fúziós szinaptikus membrán és szekréciós vezikulumokban neurotranszmitterek, és ahol az idegi impulzus lép fel, az egyik az elsődleges adathordozó.
Szállítási nagy részecskéket viszünk be a sejtbe endocitózis. A sejt lenyeli részecskéket a környezetet, amelyben vannak burkolva a plazma membránnal van kialakítva üreges, a web megsemmisül, és a tartály belsejében a sejt. Szétszerelés - ez egy másik történet, és ki kell emelnünk, hogy a endocitózis és exocitózis közvetíti a különböző fehérjék, amelyek jellege és hatásmechanizmusa nem teljesen telepítve.
Amellett, hogy a „hasznos” egyesülő sejt minden alkalommal megy keresztül egyesülési ügyek „káros”. Például amikor támad a vírus, ami elég ahhoz, hogy azt mondják: „Open Sesame!”, És egy lipid membrán a vírus fuzionál a plazma membránnal. Ez képezi az úgynevezett idő fúziós, és a virális DNS-t vagy RNS-t kezdeni belül gazdasejtekben. Az igazságosság meg kell jegyezni, hogy az egyedülálló képességét vírusok „nyitott széfek” már a javára a szervezetben. A génterápia vírusok ártalmatlanok pick-keksz, ami varrni hasznos gént, amely segít a beteg sejt.
Ahhoz, hogy megértsük a fizikai mechanizmusát az egyesülés biológiai objektumok rendkívül nehéz. Mint mindig ilyen esetekben jön a támogatás a modell rendszerekben. Utalva a közelmúltban, hangsúlyozni kell, hogy a közép-80 ért el lenyűgöző nyereséget a tanulmány a mechanizmus fúziós lipid kettős [1]. Ugyanakkor a közép-90 kiderült: közbenső eljárásban hozott az elméleti modellek, nagy az energia, így a tervezési sebesség, ellentétben a kísérleti adatok, elhanyagolható. Ezen kívül, bár azt is kimutatták, hogy a különleges fehérjék fontos szerepet játszanak az egyesüléssel nem volt világos, hogy mit csinálnak. A megoldás ezekre a problémákra szenteltek már kísérleti és elméleti munka, a laboratórium végzett a második felében a 90-es évek.
Az útvonal a vírus a sejtbe
vírus világ nagyon változatos. Közös számukra, hogy genetikai anyag (formájában DNS vagy RNS) gondosan csomagolva védőöltözet fehérjék. A vírusrészecskék (virionok) különböznek alakja és mérete. Így, az átmérője a gömb alakú virionok - 20-300 nm. Egyes vírusok egy további lipid borítékba, amely magában foglalja a speciális fehérjék, amelyek elősegítik a membránfúziót. Az ilyen vírusok nevezzük burkolva. lipid-fehérje boríték kettős követelmény. Egyrészt meg kell védeni a genetikai anyagot a viszontagságos élet, de a másik - ez könnyen összeomlik, amikor a vírus kezdi az aktív élet a sejteken belül az áldozat.
Burokkal rendelkező vírusok bejutnak a sejtbe két módon. Az előbbi esetben, a vírus kötődik a sejtfelszíni receptorokhoz, majd ennek eredményeként az endocitózis, tartalmazó vezikulák virion bud. Ebben az állapotban a vírus van csomagolva egy további kialakított héj a sejtmembránon. A második köpeny, amikor felszabadul a endoszóma vezikula összefolyása, amelyben a savas környezetben aktiválódik fúziós fehérjék, és így hozzájárul a egyesülés endoszomális membránon a virion. Ennek eredményeként, a genetikai anyag kerül a citoplazmában, és hogy a mag. A kezdeti szakaszban ez a folyamat, beleértve behatolás a endoszóma a vírus passzív szerepet játszik. Ez használ a szokásos mechanizmusát endocitózis és bízva a sejt nem is tudja, mik a veszélyek e „ajándék a sors.” És csak egyszer az endoszóma, a vírus aktiválódik, és azon a játék vége, ami a fúziós azok membránok endoszomális membránon. Úgy működik, mint egy jól ismert influenza vírus.
Két út burokkal vírus behatolását a sejtbe.
Bal - endocitózis és a fúziós a endoszóma 1 - vírus, 2 - endoszóma, 3 - mag.
Jobb - fúziót a plazmamembrán.
Más vírusok, például a humán immunhiány vírus (HIV), nem kell, hogy aktiválja az alacsony pH és behatolni a sejtbe egy egyszerűbb módon, amelyben héjában azonnal egyesül a plazmamembrán, és az örökletes anyag egy cellát. Most csak, hogy a mag.
Így, minden esetben, egy kulcsfontosságú esemény a harcot burokkal vírus egy sejt - összevonása a lipid borítékot a plazma vagy a lizoszomális membránon. Ez az döntő szakaszában sejtfertőzéséhez és elkötelezett a mi történetünk. Pontosabban, fogunk összpontosítani az influenzavírus A. sajátosságai miatt a szerkezetük, ez volt a legkényelmesebb tárgy kísérleti vizsgálata mechanizmusának fúzió.
Ez a burokkal rendelkező vírus közelítőleg gömb alakú, átmérője körülbelül 0,13 mikron. A központi része számos RNS-molekulák és fehérjék szükséges a vírus korai szakaszában az élet egy ketrecben. A mag a virion héj veszi körül őket az M1 fehérje, mögötte egy lipid membrán. Protein héj, süllyesztve a lipid membrán, hasonlít egy halászháló, amely fel van szerelve gólyalábas. méret a sejtek a fehérjét hálózatban mintegy ¥ 4 4 2. nm úgy, hogy egy ilyen nagy „hal”, mint komplex RNS-fehérje, hogy áthaladjon őket nem. A lipidburokkal képződik a plazma membrán a fertőzött sejteket a vírus bimbózó szintetizált. Ebben a három membránhoz lehorgonyzott fehérje: neuraminidáz (N), az ioncsatorna M2 és hemagglutinin (HA). Amikor a savanyítás a közeg révén ioncsatorna belsejében a virion csökken pH, ami a pusztulását az M1 fehérje héj. Ugyanakkor aktiválja a hemagglutinin, a fő összetevője az „egyesülő a gépet.” A munkája során a vírus membrán és a sejteket zárva vannak, és a citoplazma megnyitja az utat az idegen genetikai anyag.
Vezetési influenza virion:
HA - hemagglutinin, M2, - ioncsatorna, H - neuraminidáz, M1 - fehérje héj.
A felszínen a vírusburok hemagglutinin van jelen trimerek. Mind a molekula két alegységből áll: HA1, amely az elsődleges érintkezés a célsejt, és FG2 felelős fúziós. A kezdeti, semleges, állapot (pH = 7) az összes trimerek megközelítőleg merőleges a membrán felületén, a mellék
13 nm. Mindegyik molekula HA szilárdan a membránt, és nagyon fontos, ez áll egy rövid (25 aminosav) peptid, amely pH = 7 elrejtve a trimer és a lokalizálódik, közel a protein bázis. Miután csökkentve a pH 7-5 hemagglutinin molekula globálisan átrendeződött és a fúziós peptid nem egyszerűen megy szabad és átkerül a legfelső végéig a molekula és behatol a membrán az áldozat.
Szerkezete, a hemagglutinin Eredeti (pH = 7) és az aktív (pH = 5) állapotok.
Színes jelölt fúziós peptidet, amely a savas környezet változik a konfigurációját.
A semleges közegben hemagglutinin molekula hasonlít a tavaszi befogott reteszt, amely szerepet tölt be a fúziós peptidet, elrejtve a „hidrofób zseb” trimer. De szükség van a pH csökkentésére 5, mint peptid felmerül a fogságból, és HA molekula lehet menni egy új konformációs állapotban. Felszabaduló energia ennek a mérések szerint igen magas, de még mindig nem elég a konvergencia sejtmembránok, és a vírus. Hogy oldja meg ezt a problémát, a hemagglutinin molekulák nem jár egyedül, de együtt. A kísérletek azt mutatták, hogy közben a kölcsönhatás a vírus a célsejt rozetták kialakított hat-nyolc trimer, amelynek minden egyes lipid ívelt részek sugarú
10 nm. A rendszer segítségével a elektronmikroszkópiával és elektrofiziológiai vizsgálatok azt találtuk, mint a helyi duzzanat, úgynevezett Dimple [2].
Itt, a tetejét Dimple kezdődik átszervezése lipidek képződéséhez vezet a fúziós pórusok. Elméleti modell a folyamat [3] a következő: fúziós fehérjék, a membrán flexing nemcsak közelebb hozza, hanem biztosítja az energia, megkönnyítve a kialakulása egy egyrétegű szövedékek - Stalker; lipidegyrétegek távoli deformálódnak nélkül nagy energiaráfordítás. Ennek eredményeképpen, az új közbenső kialakított szerkezetek - alacsony energiájú intermedierek, amely egyesülés.
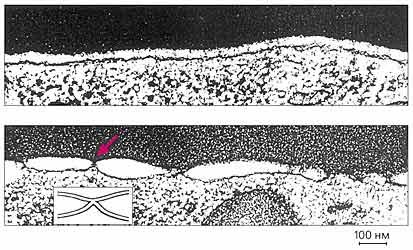
Dimple képződés a membránok között a vörös vérsejtek és expresszáló sejtek a hemagglutinin.
Fent - határa a eritrocita membránok és a sejtek expresszáló HA, pH = 7,4;
az alsó - az azonos, de pH = 4,9 - látható egy nagy számú érintkezési régiók (színes nyíl).
A beékelt ábra mutatja a kapcsolatot.
A sejtfúzió, vírus vagy sejt organellum membránok érteni Association Limited mennyiségű vizet és membránok magukat. Ahhoz, hogy nyomon ezt a folyamatot egy lipidben oldható fluoreszcens címkék. Ha egy ilyen címke eredetileg tartalmazta a sejtekben az A, majd a megjelenését a sejtekben az említett egyesülés. Vannak azonban olyan esetek, amikor van egy úgynevezett polusliyanie, azaz kombinálni csak a külső egysejtrétegekre, a konvergencia lokalizált kapcsolatot. Ahhoz, hogy különbséget tesz kapott és teljes fúziós, a sejteket adjuk A vízoldékony festéket. A túlfolyó egyik cellából a másikba jelzi a teljes egyesülés alkotnak pórus, amelyen keresztül a kommunikáció. Így, kísérletekben feltárása fúziós tömeges, például szuszpenzió a vírusokra és sejtekre. Azonban a képességeit a technika korlátozott, és nehezen érthető az az eljárás részleteit, beleértve a helyileg fellépő érintkezés előfordulását pórusok és annak fejlődését. Ilyen probléma megoldható csak a használata pontosabb módszer, amely lehetővé teszi, hogy nyomon egyetlen tárgy, azaz technikák alkalmazásával a fluoreszcens mikroszkópia és elektrofiziológiai modern. Ez elsőként a tanulmány exocitózisának hízósejtek alkalmazásával mikroelektronikai technológia.
Egy tipikus kísérletben egyesülés HAb2 eritrocita sejtek és savanyítás, a környező oldat pH = 5 értékre pórusok formájában. Ezen keresztül áramlik a kapacitív áram tölti a vörösvértest. A időbeli változást tükrözi a bővítés a fúziós pórusok. Egyidejűleg a membrán a vörösvértest membrán HAb2 folyik festék. Összehasonlítva a két görbe (fluoreszcencia intenzitás és vezetési) mutatja az időben észre, hogy a második messze elmarad az első. Feltételezzük, hogy ez a késleltetés okozta fehérje hemagglutinin trimereket az aljzatból, amely egy fajta akadályt az áramlás a lipid szonda. Kezdeti idő, hogy fúziós képződik a lipid Dimple. Következésképpen, a változó a lipid-összetétel a membrán befolyásolhatja a teljes folyamatot. Amikor közeledik a lipid kettős között kialakítható a szomszédos híd egyrétegű (ún szár) az embrió jövő pórusokat. Annak a valószínűsége, a képződésének nagymértékben függ a lipid készítmény. Így például az adagolás egyrétegű lizofoszfatidil-kolin (LPC), még kis koncentrációban teljesen gátolta a fúzió. Kísérletek már HAb2 vörösvérsejt azt mutatta, hogy lizofoszfatidilkolinnal ugyanolyan hatékony, mint a modell lipid rendszerekben. Más szóval, itt az ideje, hogy egyesíti bevezetése után LPC nem merül fel egyáltalán, bár ítélve megjelenése fluoreszcencia, egyrétegű egyesítjük.
Görbék pórusok vezetőképesség (szín) és a fluoreszcencia intenzitást.
Fent - ellenőrzés,
alján - ugyanazt a rendszert, de azzal a kiegészítéssel, lizofoszfatidil-kolin.
A függőleges tengely - a vezetőképesség a vízszintes tengely mentén - az időben.
Így a HA molekula elő lipid golf játék. De az ügy nem kizárólagosan, a fehérje részt vesz a későbbiekben is. Bizonyos kísérletekben, amikor fehérje aktivitás csökken (például csökkenti a mértékét az oldat savanyítása), ahelyett, hogy a teljes fúzió és a pórusok képződését bekövetkezik polusliyanie, azaz lipid szondát újra elosztják a sejtek között, és nincs áram. Ez azt jelenti, hogy megalakulása után a kapcsolatok és a kialakulását fehérje jumper végezni bizonyos szükséges munka előfordulása a pórusokat. Ezek a fontos eredményeket kaptunk a csoport L.V.Chernomordika a National Institutes of Health (USA), és az elektrofiziológiai méréseket laboratóriumunkban alkalmazottja V.A.Frolovym [4]. A kísérletek eredményei kombinálva elméleti modellek hagyjuk hez egy bizonyos minta egyesítési folyamat, amely négy lépést.
Reakcióvázlat fúziós folyamatot.
Miután a pH csökkentése a képződött fúziós aljzat (1),
amely elősegíti a kialakulását a helyi kapcsolati a membrán (2)
és egy jumper, amelyet azután alakítjuk fúziós pórus (3, 4).
Azonban bármilyen modell mindig különbözik a valódi tárgyat. HAb2 sejtmembrán lipid eltérő összetételű, mint a virion membrán, és más hemagglutinin sűrűség és a sejtszerkezet HAb2 tartalmaz M1 és M2 fehérjék. Laboratóriumunkban kifejlesztett technika lehetővé teszi számunkra, hogy tanulmányozza a fúziós a virion egyetlen kétrétegű lipid membrán [5]. Egy semleges környezetben (pH 7 puffer oldat) injektálunk virionok, amelyek közül néhány adszorbeálódik a kétrétegű. Ezt követően, a membránt nyomja neki a lapos mikropipetta van töltve oldattal pH = 5. Mivel a pipetta hegyét sugara
1 mm, akkor valószínű, hogy a belsejébe, a lipid tapaszt, lesz egy vagy több virionok, egy membránt, mely be van építve a önkioltóak fluoreszcens próba koncentrációja. Az alacsony pH-kiváltja a fúziós belsejében a pipetta és a szonda diffundál a kétrétegű. A kapott hígítást eredményez fluoreszcencia, amely kimutatható.
A kísérleti elrendezés. Lásd a szövegben a részletekért.
Elektromos mérések azt mutatták, hogy együtt a laterális áramlási szondát ingadozó elektromos áram keletkezik, amely átfolyik a pórus beolvadó és bármilyen vezető struktúrák a membránban a vírus. Különleges kísérletek bebizonyították, hogy ez a helyzet olyan módon [6]. Ezekben a kísérletekben, az M2 ioncsatorna blokkolt amantadin, és a savtartalom a virion elteltével érte el a pH-csökkenés (5) Az alsó rekeszbe a cella. Nyilvánvaló, hogy ez a kísérleti elrendezés után azonnal a fúziós protonok az alsó rekeszbe kell rohanás a nyíláson keresztül a virion időt, amely elpusztítja a fehérje shell az M1 akkor is, ha M2 blokkolt csatornák. Valóban, ilyen körülmények között is van elektromos aktivitást, pontosan ugyanaz, mint az M2 nyitott csatornákon. Tehát így lehet monitor nem csak az evolúció a fúziós pórusok lipid membránba, hanem a pusztítás a fehérje hálózatot. Ez rendkívül fontos, mivel a hozam a virális genetikai anyag a citoplazmába korlátozza mind a védő héj - fehérje és lipid.
Így egyesíti a technikákat elektronmikroszkópos és elektrofiziológiai sikerült megtalálni a helyi kapcsolatok membrán (gödröcskék). Bevezetés lizolipida gátolja biológiai fúziós, ami azt bizonyítja, hogy az első közbenső eljárással, mint a modellrendszerekben, szolgál egy jumper (szár).
A kidolgozott módszer tanulmányozása való egyesülés egyetlen viriont lipid kettős lehetővé teszi számunkra, hogy vizsgálja meg a kinetikai folyamat és egyesíti a modell, amely egy alapvetően új intermedierek, amely megoldja a problémát a „energiaválság”.
Szerepének tisztázása a lipidek és a fehérjék ez a folyamat nem csak a kognitív érdeke. A jövőben fontos az új antivirális terápiát.
Az eredményeket kaptunk tanulmányok támogatták RFFI:
№93-04-20590, №96-04-50779, №99-04-48427 és №02-04-48287.
1. Chernomordik LV Melikyan, GB Chizmadzhev YA // Biol. membrán. 1987 4. kötet. S.117-164.