szerves kémia
Oxo-vegyület. Aldehidek és ketonok.
Oxocsoporttal vegyületek például a szerves vegyületek, amelyek egy oxocsoporttal:
Kommunikáció a szén oxigénnel oxocsoport - kettős (1-1 és - kötés). szénatomján a karbonilcsoport a karbonilcsoport. A nagy elektronegativitása oxigén polarizálja kötés előfordul részleges pozitív töltést a karbonil-szénatomon:
A ketonok mind a maradék szénatomok vegyértékei foglalt karbonil szénhidrogéncsoportok:
Az aldehideket a karbonil szénatom kötődik egy hidrogén:
Attól függően, hogy milyen típusú szénhidrogén-csoport aldehidek és ketonok vannak osztva korlátozó, telítetlen és aromás. Az oxocsoport is lehet több, rendre az esetben például, a jelenléte a molekulában két oxocsoportot létezhetnek dialdehid és diketon ketoaldehyde. Aldehideket és ketonokat azonos számú szénatomot tartalmazó izomer egymáshoz. Az alábbi táblázat néhány oxo-vegyületek.
Fizikai tulajdonságai aldehidek és ketonok
A hőmérséklet forráspontú aldehidek és ketonok növeli a molekulatömeg növekedésével. Az ugyanazt a szerkezet a szénhidrogéncsoport ketonok valamivel magasabb forráspontú képest aldehidek. A forráspontja aldehidek és ketonok miután elágazó láncú szénhidrogéncsoport (elágazó láncú) alacsonyabb, mint az egyenes láncú gyök (normális szerkezetét). Összehasonlítva alkoholok sootvetvuyuschego szerkezettel alacsonyabb forráspontú, mivel a gyengébb egyesület a molekulák miatt hidrogénkötések.
Aldehidek és ketonok van szaga. Alsó aldehidek és ketonok jól oldódik vízben.
Kémiai tulajdonságait aldehidek és ketonok
Bizonyos reakciókban, mint például a nukleofil addíciós reakciók, aldehidek és ketonok a viselkedés hasonló, más reakciók, például oxidációs reakciók, akkor jelentős mértékben eltér.
Nukleofil addíciós reakcióban AN
Karbonil szén eléggé elektrofil centrum:
és könnyen támadható a nukleofil faj.
A vizes oldatok oxo-vegyület kapcsolódik hidrogén-cianid HCN. Ennek eredményeként a disszociációs
képződött cianid-ionokat CN - - részecskék nukleofil támadják szénatomjához:
Ennek eredményeként, összeköttetés van kialakítva anion I, amely egy alkoxid-ion (erős bázis), amely részét hozzáadása után a proton reakciótermék II - hidroxi-nitril (másik neve a vegyületek ezen csoportját - ciánhidrin).
Adagolását kis mennyiségű alkálifém-a reakcióelegyben drámaian gyorsítja a reakciót, míg egy sav hozzáadásával lehet megállítani teljesen. Ez azt bizonyítja, hogy a reakció mechanizmusa nukleofil addíciós - lúg hozzáadásával növeli a cianid-ion KN - kötődve protonok, míg a sav adagolásával disszociációs ravneovesie HCN balra mozog, ami egy éles csökkenés a koncentráció KN - ionok.
Alkoholok nukleofilen csatlakozott aldehidek és ketonok, így félacetálok (lúgos vagy semleges közegben):
Ha az expozíció savas, a reakció előrehaladtával, már mint egy nukleofil zameshenie így acetálok. Először is, a protonált hemiacetál hidroxil oxigén és a víz molekula levelek, ebben a lépésben képződött kation I:
amely reakcióba lép egy másik molekulával alkohol képez reakcióterméket - acetál.
Acetálok és félacetálok osztályába tartoznak éterek.
Igazítása oxo anyagokat tartalmazó aminocsoport X-NH 2. A nukleofil aminocsoport okozott a nem megosztott elektronpár a nitrogénatom. A reakció mechanizmusa az általános formában:
Nukleofil támadás és a keletkezett intermedier részecske egy töltés-szeparált:
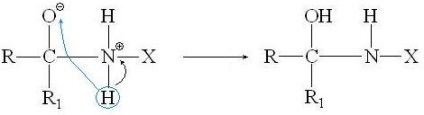
és a hasítási A vízmolekula:
Pontosan ugyanazt a reakció mechanizmusa abban az esetben, aldehidek, ez elegendő kicserélni a R1 hidrogénatom.
Az alábbiakban felsorolunk néhány lehetséges nevét reagensek és kívül termékeket.