Móltömeg a metán (CH4), és példák a általános képletű
Móltömeg metán
Metán (Marsh gáz, bányagáz) normál körülmények között színtelen gáz, rendelkezik nincs szaga.
A molekula tetraéderes formában metán (struktúra az 1. ábrán látható) a hibridizációs adja vegyérték elektronok szén, ezért a szénatom sp3 -gibridizatsii.Rastvorim etanolban, éterben, szénhidrogénekben és gyengén oldódik vízben (45 ml, 1 l víz 20 o C-on).
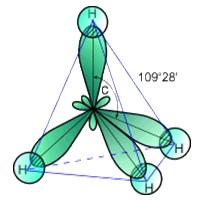
Ábra. 1. Szerkezet a metán molekula.
Molekuláris képlet metán - CH4. Mint ismeretes, a molekulatömege a molekula az összege a relatív atomi tömegek a atom alkotja a molekula (relatív atomtömeg értékeket vett Mendeleev Periódusos Táblázat egész számra kerekítve).
Mr (CH4) = Ar (C) + 4 × Ar (H);
Mr (CH4) = 12 × 4 + 1 = 12 + 4 = 16.
Móltömeg (M) - a súlya 1 mol hatóanyagra vonatkoztatva. Könnyen azt mutatják, hogy a számértékek a moláris tömege, és a relatív molekulatömeg úr egyenlő, de az első érték az alábbi méretekkel rendelkezik [M] = g / mol, és egy második dimenzió:
Ez azt jelenti, hogy a molekulatömeg-metán 16 g / mol.
A moláris tömege az anyag gáz halmazállapotú lehet meghatározni fogalmát használva annak moláris térfogata. Ahhoz, hogy megtalálja ebben a kötetben elfoglalt normál körülmények között egy bizonyos anyag tömege, majd kiszámítja a súlya 22,4 liter ez az anyag azonos körülmények között.
E cél elérése érdekében (számítása moláris tömeg) használhatják az ideális gáztörvény (Mengyelejev-Clapeyron egyenlet):
ahol p - Gáz nyomás (Pa), V - a gáz mennyisége (m 3), m - anyag tömege (g), M - moláris tömege anyag (g / mol) T - abszolút hőmérséklet (K), R - az univerzális gázállandó egyenlő 8,314 J / (mol × K).
Példák problémák megoldása
Tedd képletű hidrogén-vegyületet, jód és oxigént, ha a tömegarányai elemek benne: ω (H) = 2,2%, ω (I) = 55,7%, ω (O) = 42,1%.
Tömeghányada X elem a molekulában HX készítmény kiszámítani a következő képlet:
ω (X) = n × Ar (X) / M (HX) × 100%.
Jelöljük a mólszáma tartozó elemek a csatlakozások az „x” (H) „y” (jód), «z» (oxigén). Ezután a mólarány a következő lesz (az értékek a relatív atomi tömegeket vett Mendeleev periódusos, egész számra kerekítve):
x: y: z = ω (H) / Ar (H). ω (I) / Ar (I). ω (O) / Ar (O);
x: y: z = 2,2 / 1. 55,7 / 127: 42,1 / 16;
x: y: z = 2,2. 0,44: 2,63 = 5. 1. 6.
Ezért általános képletű hidrogén-vegyületet, jód és oxigén nézni H5 IO6.
Tedd képletű kálium, kén és oxigén, ha a tömegarányai elemek benne: ω (K) = 30,75%, ω (S) = 25,21%, ω (O) = 44,04%.
Tömeghányada X elem a molekulában HX készítmény kiszámítani a következő képlet:
ω (X) = n × Ar (X) / M (HX) × 100%.
Jelöljük a mólszáma tartozó elemek a csatlakozások az „x” (kálium) „y” (kén), «z» (oxigén). Ezután a mólarány a következő lesz (az értékek a relatív atomi tömegeket vett Mendeleev periódusos, egész számra kerekítve):
x: y: z = ω (K) / Ar (K). ω (S) / Ar (S). ω (O) / Ar (O);
x: y: z = 30,75 / 39. 25,21 / 32: 44,04 / 16;
x: y: z = 0,78. 0,78: 2,75 = 1. 1. 3.
Ezért általános képletű kálium, kén és oxigén lesz a formában SO3.