Molekuláris és kémiai reakció eljárás
Rend a reakció az összege a kitevőket koncentrációjának tényezők, amelyek meghatározzák a változás a reakció sebességét.
A kinetikai egyenlet formájában (8) egyenlő a sorrendben a reakció:
A komplexum reakciók nem mindig lehet megállapítani a sorrendben a reakció, amely figyelembe veszi a hatása valamennyi reagens. Ebben az esetben, a sorrendben a reakció használja a koncepció egy anyag, például, a sorrendben a reakció az anyag A.
Ebből következik, hogy a sebességi állandó mindig számszerűen egyenlő a reakció sebessége a készülék koncentrációt és a méret függ az, hogy a reakció.
kémiai reakció molekularitás száma határozza meg a molekulák (részecskék) részt az elemi reakcióban esemény.
Megkülönböztetik az egyik (A = B A = B + C; A = B + C + D), két (2A = B, A + B = C), és a három-molekula (A + 2B = C; 3A = C) reakciót .
Okai eltérések és sorrendjét a molekuláris reakciók.
N és molekuláris oryadok egybeesik csak egyszerű egyfokozatú reakciók. Ennek két oka van az eltérések és molekuláris sorrendben:
1. állandóságát koncentrációját egy vagy több résztvevő a reakcióban (a reakció a légkörben).
2. A lépcsős a reakció természete (ha a reakció 2A + B = C két lépésben, a sorrendben a második, és a molekularitás egyenlő három).
Ha az egyedi sebesség szakaszok igen különböző, akkor a reakció sebessége általában, és annak érdekében, határozza meg a sebességet, és a sorrendben a leglassabb lépésben.
Nem minden a kinetikus egyenletek formájában (8) egyenlet, hogy azok tartalmazzák bonyolultabb funkciókat kezdeti koncentrációk, reakciótermékek, katalizátorok, inhibitorok. Ha a reakciót két módon, például katalitikus és nem katalitikus, a kinetikus egyenlet kell tartalmaznia két kifejezés megfelelő ezeket az útvonalakat. A teljes kinetikus egyenlet tartalmaznia kell a kifejezést az egyensúlyi állandó, azaz tartalmaznia kell a pozitív és negatív értelemben, tehát ha a reakció sebessége beállítható nullára, megkapjuk az egyenlet az egyensúlyi állandó. Azonban sok az egyensúly úgy tolódik termékek képződéséhez, amelyek megtalálhatók csak kinetikus egyenlet az előre reakciót.
A kinetikája reakciók statikus feltételek
A reakciókat általában az jellemzi, kinetikus egyenlet, amely lehetővé teszi a számítás sebességi állandó bármikor a kezdetétől, és fél-élettartam t1 / 2. amely meghatározza, hogy mikor csökkenti a kezdeti koncentrációja a reagensek felében.
A fél-időt nevezzük időintervallum, amely alatt a kezdeti koncentrációja a reaktánst a felére csökken.
nulla-rendű reakció
Van egy reakció sebessége, amely nem változik a koncentráció egy vagy több reaktáns, mivel nem meghatározott koncentrációjú, és számos más korlátozó tényezők, például a felszívódás a fény egy fotokémiai reakció vagy a katalizátor mennyisége a katalitikus reakciókban. Is vonatkozik, hasonló reakciókat az égési légkörben. majd
A katalitikus reakció lehet tekintetében első rendű, a katalizátor és a nulladrendű tekintetében a reagensek.
Az integrációs konstans található a kezdeti feltételeket a t = 0, C = c0. Ezután const = c0, és az egyenlet a következő lesz:
Ez fejezi ki a lineáris a koncentrációtól függően és az idő határozza meg, hogy a sebességi állandó k0 = TGA-nál.
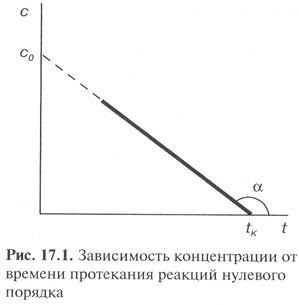
Tól (11) a kinetikus egyenlet kapható egy nulladrendű reakciót
A dimenziója sebességi állandó mol / l · s.
Szerint a (13) egyenlet tudjuk megszerezni a kifejezés a felezési ideje egy nulladrendű reakciót.
A fél-időszak nulladrendű reakció egyenesen arányos a kezdeti koncentrációját az anyag.
Elsőrendű reakció
A reakció sebessége által leírt egy elsőrendű kinetikus egyenlet a következőképpen:
Az integrációs konstans meghatározása a feltétel: a t = 0 c = c0. majd
Ez az egyenlet felírható másképp
Ez látható a következő egyenletből, hogy a dimenzió k1 független a koncentrációja a kifejezés. Ha ábrázoljuk ln c t a lejtőn fogja meghatározni a sebességi állandó.
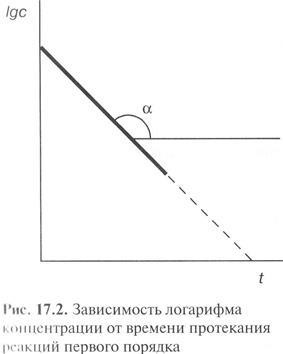
A félperiódus egy elsőrendű reakcióban
és nem függ a kezdeti koncentráció a reaktánsok.
másodrendű reakció
A reakció sebessége határozza meg a második rendű kinetikai egyenlettel:
Ha a koncentrációk egyenlő
Ebből következik:
Elválasztó változó és integrálása, van
Az integrációs állandó a feltétel: a t = 0 c = c0
A lineáris függését a másodrendű reakció lép fel az koordinátákat 1 / s - t. A lejtőn az arány állandó.
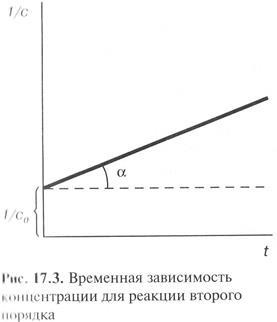
A félperiódus egy másodrendű reakció:
A félperiódus egy másodrendű reakciók fordítottan arányos a kiindulási anyagok koncentrációjának.
A reakciókat a harmadik és a magasabb rendű ritkák.