Mechanizmusok szerves reakciók - studopediya
Vannak négy fő típusa képződésével járó reakciókat szerves vegyületek: helyettesítés (elmozdulás), Ezenkívül, eliminációs (hasítási) átrendeződés.
3.1 szubsztitúciós reakciók
Az első típusú szubsztitúciós reakciók általában akkor fordul elő egy szénatomon, de szubsztituált atomot lehet hidrogénatom vagy bármilyen más atom vagy atomcsoport. A elektrofil szubsztitúciós gyakran helyébe hidrogénatom; példa a klasszikus aromás szubsztitúciós:
Amikor a nukleofil szubsztitúciós gyakran nem helyettesíthető a hidrogénatom és a többi atom, például:
NC - + R-Br → NC-R + BR -
3.2 Az addíciós reakciót
addíciós reakció is elektrofil, nukleofil vagy radikális típusú, attól függően, hogy a részecske a folyamat megkezdése. Csatolása egy hagyományos kettős szén-szén kötést indukálódik, jellemzően egy elektrofil csoport vagy. Például összekötő HBr
Lehet kezdeni támadás a kettős kötés proton H +, vagy egy radikális Br ·.
3.3 reakciói megszüntetése
eliminációs reakció lényegében fordítottja a kapcsolási reakció; A leggyakoribb típus az ilyen reakció - hasítását egy hidrogénatom és egy másik atom vagy csoport a szomszédos szénatommal együtt alkének:
3.4 átrendeződési reakciót
Átrendeződés is köztiterméken keresztül folytatódik a vegyületek, amelyek kationok, anionok vagy gyökök; A legtöbb ilyen reakció folytassa a kialakulását karbokationok vagy más elektron-részecskék. Átrendeződés tartalmazhat egy jelentős átalakítása a szénváz. Az átrendeződés során fellépő magát ilyen reakciók gyakran követik lépésben szubsztitúciójával, addíciójával vagy hasítási ezáltal stabil végtermék.
Részletes leírása kémiai reakciólépést nevezett mechanizmussal. Egy elektronikus szempontjából a kémiai reakció alatt módon, hogy megértsék a mechanizmus a törés a kovalens kötések a molekulák és az állam szekvenciát, amelyen keresztül a reaktánsok átalakítás előtt a reakció termékek.
4.1 gyökös reakció a
Szabad gyökös reakciók - kémiai folyamatok, amelyek magukban foglalják molekulák párosítatlan elektront. Bizonyos szempontból a szabadgyök reakciók egyedülálló képest más típusú reakciókat. A fő különbség abban rejlik, hogy sok a szabad gyök reakciók lánc. Ez azt jelenti, hogy létezik egy mechanizmus, amellyel több molekulák alakítjuk termék alkalmazásával egy iteratív folyamat, kezdeményezett létrehozását egy reaktív részecskék. Egy tipikus példa illusztrálja a következő hipotetikus mechanizmus:
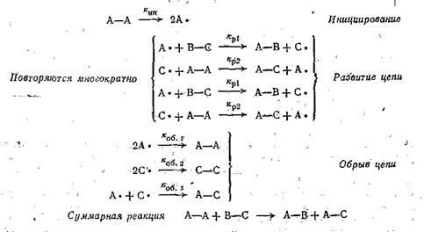
Lépést, amelyben a reakció közbenső keletkezik ebben az esetben, A +, az úgynevezett iniciációs. Ezt a lépést úgy hajtjuk végre magas hőmérsékleten, UV vagy peroxid, nem poláros oldószerekben. A következő négy egyenlet Az e példa ismétlődő szekvenciájából két reakció; ezek képviselik a fejlesztési fázisban lánc. Láncreakció jellemzi a lánc hossza megfelel a lépések számát egy inicializálási lépésben. A második lépés történik, miközben a vegyület szintézisét, és kialakulását egy új csoport, amely továbbra is a lánc transzformációk. Az utolsó lépés egy olyan lépést, egy nyitott áramkör, amely magában foglalja a bármilyen reakciót, amely megtöri a reakció egyik intermedierek, fejlesztéséhez szükséges a lánc. Minél nagyobb a láncterminációs lépéseket, a kisebb lesz a hossza a lánc.
A szabad gyökös reakciók játszódnak le: 1) a fény, magas hőmérsékleten, vagy jelenlétében keletkező gyökök bomlása során egyéb anyagok; 2) gátolja anyagok könnyen reagálnak szabad gyökök; 3) kerül sor a nem-poláros oldószerek, vagy a gőzfázisban; 4) gyakran autokatalitikus, és egy indukciós periódus reakció előtt; 5) viszonyítva a kinetikus lánc.
gyökös szubsztitúciós reakciók jellemző alkánok és gyökös addíciós - az alkén és alkin.
CH3 -C = CH + HCI → CH3-CH = CHCI
Közötti kapcsolat a szabad gyökök és a lánc-terminációs fordul elő elsősorban a reaktor falain.
4.2 Ionos reakciót
Reakció, ami a heterolitikus kötés törés és képeznek közbenső részecskék ionos típusú, úgynevezett ionos reakciókkal.
Ionos reakciók lépnek fel: 1) a katalizátor jelenlétében (savak vagy bázisok, és nem befolyásolja a fény vagy a szabad gyökök, különösen adódó bomlási peroxidok); 2) nincs hatással a szabad gyökfogó anyagokat; 3) során a reakciót befolyásolja az oldószer jellegét illetően; 4) ritkán fordulnak elő a gőzfázisban; 5) kinematikusan lényegében reakciók első vagy másodrendű.
Az a reagens jellegétől, az aktív molekula, ionos reakciókkal vannak osztva elektrofil és nukleofil. nukleofil szubsztitúciós reakciók jellemző alkil- és aril-halogenidek,
elektrofil szubsztitúciós - az alkánok jelenlétében katalizátorok