Egyszerű (egyszeres) kötést eredményező típusú kötések a Bioorganic vegyületek
Vegyérték elektronok. Hibrid (hibridizálódnak) orbitális. kötéshossz
Jellemzői kémiai kötések a Bioorganic csatlakoztatott eniyah ??
KAPCSOLÓDÓ RENDSZER: aciklusos és ciklusos.
1. Jellemzői kémiai kötések a Bioorganic csatlakoztatott ?? eniyah. A hibridizációs pályák szénatomok.
2. Besorolás konjugált rendszerek: aciklusos és ciklusos.
3 fajta ragozás. π. pi és π. r
4. stabilitási kritériumok konjugált rendszerek - „” energia sopryazheniya '
5. Az aciklikus (nem ciklikus) konjugált rendszerek, típusú konjugáció. Major képviselői (alkadiének, telítetlen karbonsavak, A-vitamin, karotin, likopin).
6. A gyűrűs konjugált rendszerek. aromássági kritériumoknak. Hückel szabály. A szerepe a π-π-. π- # 961; -conjugacy kialakulását aromás rendszerek.
7.Karbotsiklicheskie aromás kapcsolt ?? eniya: (benzol, naftalin, antracén, fenantrén, fenol, anilin, benzoesav) - szerkezete, kialakulása egy aromás rendszer.
8. A heterociklusos aromás összekötő ?? Űrlapon (piridin, pirimidin, pirrol, purin, imidazol, furán, tiofén) - szerkezetét, különösen a kialakulása egy aromás rendszer. Hibridizációja elektron pályák a nitrogénatom a kialakulását öt - és hattagú heteroaromás összekötő ?? eny.
9. orvosbiológiai jelentőségű természetes összekötő ?? eny tartalmazó konjugált kötés rendszere, és az aromások.
Kezdeti tudásszint mastering témák (iskolai kémia szak):
Elektronikus konfigurációs elemek (szén, az oxigén, nitrogén, hidrogén, kén. Halogének) „” orbitális „” fogalmát, hibridizáció és térbeli orientációját a pályaelemek 2 időszakban. típusú kémiai kötések, különösen kovalens # 963; s π -kötéseken változás elektronegativitási elemeket abban az időszakban, és a csoport. osztályozási és terminológia elvei szerves összekötő ?? eny.
Szerves molekulákat kialakított kovalens kötésekkel. Kovalens kötések fordulnak elő a két mag miatt a teljes atomok (szocializált) elektronpár. Ez a módszer tárgya a csere mechanizmus. Alakult apoláris és poláris kötések.
Apoláros kötés jellemzi szimmetrikusan elosztott ?? HAND elektronsűrűség a két atom, amely összeköti ezt a kapcsolatot.
Polar kötések jellemezve Aszimmetrikus (egyenlőtlen) megosztjuk ?? HAND elektronsűrűség fordul elő az irányt az elmozdulás több elektronegatív atommal.
Sorokban elektronegativitási (húzott lefelé)
A) Sejtek: F> O> N> C1> Br> I
B) szénatom: C (SP)> C (SP 2)> C (SP 3)
Kovalens kötés két típusa van: a szigma ( # 963;) és a pi (π).
A szerves molekulák Sigma (# 963;) kötések vannak kialakítva elektronok, elhelyezve a hibrid (hibridizált) pálya, az elektronsűrűség található az atomok között a képzeletbeli vonal azokat összekötő.
π -bond (pi -bond) fordul elő, ha az átfedés a két nem-hibridizált p pályák. Ezek fő tengelyei párhuzamosak egymással, és merőlegesek vonalak # 963; -bond. kombináció # 963; --svyazey és π nevezzük kettős (többszörös) linket tartalmaz két pár elektronok. A hármas kötés áll három pár egy elektronov- # 963; - és két π -bond (Bioorganic csatlakoztatva ?? eniyah rendkívül ritka) ..
# 963; -bond részt vesz a kialakulását skel ?? ETA molekulák, ezek nagy. és π -bond lehet tekinteni, mint a további, de kölcsönöz speciális kémiai tulajdonságai molekulák.
1.2. Hibridizáció 6 szénatomos
Gerjesztett állapotban elektron szénatomok konfigurációja
kifejezett megosztjuk ?? HAND elektron 1s 2s 2 2 2p 2.
A bio ?? eniyah csatlakoztatva, valamint a legtöbb szervetlen anyagok, a szénatom van egy vegyértéke egyenlő négy.
Van egy eltolódás az egyik 2s elektront egy szabad 2p orbitális. Vannak gerjesztett állapotainak a szénatom, amely létre képződésének lehetőségét a hibrid a három állapot, jelöljük C C SP 3. sp 2. sp.
Hibrid orbitális eltérő sajátosságokkal from''chistyh „” s, p, d- pályák és „” smesyu „” két vagy több típusú nem-hibridizált pályák.
Hibrid pályák sajátos csak atomok molekulák.
A koncepció a hibridizáció be 1931-ben L.Polingom. A Nobel-díj ?? evskoy,.
Tekintsük a térbeli helyzetét hibrid pályák.
C s o 3 - ↑ - - ↑ - - ↑ - - ↑ -
A gerjesztett állapotban képződött 4 ekvivalens hibrid pályák. Hely kötvények irányának felel meg a központi szöget Egy szabályos tetraéder, a szög értéke bármely két kötvények értéke 109 0 28.
A alkánok és származékaik (alkoholok, halogénezett alkánok, aminok) Sun e ?? szénatomos, az oxigén-, nitrogén- ugyanabban sp3 hibrid állapotú. szénatom képez négy három nitrogénatomot, egy oxigénatomot, két kovalens # 963; -bond. Mintegy e kapcsolatok szabadon forgatható részei a molekula egymáshoz képest.
A gerjesztett állapot bekövetkezik három sp 2 hibrid pályák egyenértékűek, elrendezve az elektronok alkotnak három # 963; -bond. amely található egy síkban, a bezárt szög a 120 0. nem hibridizálódott 2p - pályák a két atom WC ?? ednih formájában π-kötés. Ez merőleges a síkra, amelyben a # 963; -bond. Kölcsönhatás p elektronok ebben az esetben a név 'perekryvaniya' oldalon. Többszörös kötés nem teszi lehetővé a szabad forgását maga körül tartalmaz. A rögzített alkatrészek helyzetét a molekula képződése kíséri két sík geometriai izomer formáját, amelyek úgynevezett. cisz (cisz) - és transz (transz) - izomerek. (Cisz-latin - az egyik oldalon, transz- lat - révén).
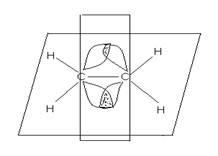
Atomokkal egy kettős kötés, olyan sp2 hibridizációs állapotban és
jelen az alkenil-aromás ?? eniyah csatlakoztatva, egy karbonilcsoport
> C = O, azometin-csoport (iminocsoport), -CH = N-
C SP 2 - - ↑ - - ↑ - - ↑ -
A szerkezeti képlet a szerves összekötő ?? eniya ábrázolt Lewis-szerkezetek (mindegyik pár elektronok közötti atomok helyébe gondolatjel)
1.3. A polarizációs kovalens kötések
Kovalens poláris kötés jellemzi egyenlőtlenül oszlik ?? HAND elektronsűrűség. Annak jelzésére, eltolási irányára az elektronsűrűség két hagyományos képekkel.
poláris # 963; - kommunikáció. Az elmozdulás a elektronsűrűség nyíl jelzi mentén linkre. A végén a nyíl felé mutat több elektronegatív atommal. A megjelenése részleges pozitív és negatív töltések pont levélben b „” „” „” delta 'a helyes jele a díjat.
b + b-b + b + b-b-b +
metanol klórmetán -aminometán (metil-amin)
Polar π-kötés. Az elmozdulás a elektronsűrűség jelzik félkör alakú (íves) feletti nyíl a pi-kötés is irányul több elektronegatív atommal. ()
1. Határozza meg a hibridizáció a szénatomok oxigén. nitrogén csatlakoztatva ?? eniyah A, B, C hívás csatlakoztatva ?? eniya. a szabályok IUPAC nómenklatúra.
2. Készítsen jelölést jellemző polarizációs iránya a nap ?? ex ezeket a kapcsolatokat az összekötő ?? eniyah (A - D)