Az elektronikus konfigurációja atomok kémiai elemek
Elemek a periódusos rendszerben a kémiai elemek
Kezdetben, az elemek a periódusos rendszerben a kémiai elemek DI Mengyelejev voltak elrendezve szerinti atomsúlyaik és kémiai tulajdonságok, de valójában kiderült, hogy döntő szerepet nem atomtömeg, és a mag töltés, és ennek megfelelően, az elektronok száma a semleges atom.
A legstabilabb állapotában az elektron egy atom egy kémiai elem megfelel a minimális energia, és bármely más, úgynevezett gerjesztett elektron képes spontán vándorolnak a szint alacsonyabb energia.
Vizsgálni, hogy a elektronok vannak elosztva az atom pályák, azaz elektronikus konfiguráció egy sok-elektron atomok alapállapotú. Az építőiparban a elektronikus konfiguráció a következő elvek töltik pályák az elektronok:
- elv (tiltás) Pauli - egy atom nem lehet két elektron azonos sor 4 kvantumszámok;
- az az elv a legalacsonyabb energiájú (Aufbau elv) - pályák vannak töltve elektronok sorrendben növekvő energia pályák (1. ábra).
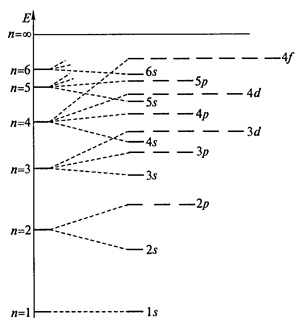
Ábra. 1. megoszlása pályák a hidrogénatom az energia; n - a főkvantumszám.
orbitális energia függ összege (n + l). Orbital elektronok töltik növekvő sorrendben a sum (n + l) az ilyen ortitaley. Így sublevels 3D és 4s összege (n + l) egyenlő lesz az 5 és 4, illetőleg, ahol az első, hogy kell tölteni 4s orbitális. Ha az összeg (n + l) azonos a két pályák, az orbitális van töltve először egy kisebb n értékét. Így, a 3D és a 4p pályák összege (n + l) egyenlő lesz 5 minden orbitális, de az első töltési 3d orbitális. Az ezekkel a szabályokkal összhangban, a megrendelés kitöltése pályák a következő:
családtag határozza meg az orbitális elektronok töltve a legkevésbé, összhangban az energia. Azonban, ha nem tud írni e formula szerint az energia ott.
41 Nb 1s 2s 2 2 2 2p 6 3s 3p 4s 6 3d 10 4d 6 4p 2 3 2 5s megfelelő rekordot az elektronikus konfiguráció
41 2 Nb 1s 2s 2p 2 6 2 3s 4s 3p 6 3d 10 2 6 4p 5S 2 4d 3 elektronszerkezet érvénytelen bejegyzést
Az első öt d - valens elemek (azaz, az elektronok képződéséért felelős a kémiai kötésre) az alábbiak összege elektronok d és s, elektronok kitöltve utolsó. A p - valens elemek összege az elektronok a s és p sublevels. Az s-Valent elemek elektronok, található egy külső alréteg s energia szintet.
- Hund-szabály - az egyik értéke l elektronok töltse az orbitális úgy, hogy a teljes centrifugálás volt maximális (2. ábra).
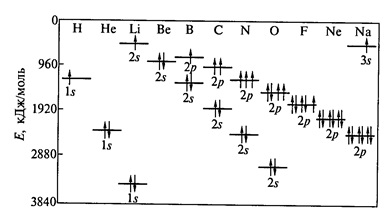
Ábra. 2. A változás az energia 1s -, 2s - 2p - pályák atomok 2. időszakától a periódusos rendszer.
Példák az építési elektronikus konfigurációk atomok
Példák az építési elektronikus konfigurációk atomok az 1. táblázatban megadott.
1. táblázat: Példák építésének elektronikus konfigurációk atomok