Alapegyenletének MKT fizika
Definíció és képlet egyenlet MKT
Egyenlet alapjául szolgáló molekuláris kinetikai elmélet kötődik makroszkopikus mennyiségek állapotának leírásakor az ideális gáz (például, nyomás) annak molekuláris paraméterei (a tömegek és a sebességek). Ez az egyenlet a következő formában:
Itt - a tömeg a gázmolekulák, - a koncentrációja az ilyen egységnyi térfogatra eső részecskék, - átlagolt négyzetes molekulák sebessége.
Alapegyenletének MKT világosan leírja, hogyan ideális gáz nyomást hoz létre a környező érfal. A molekulák minden idők érintette a falat, miközben dolgoznak rajta bizonyos erővel F. Itt meg kell felidézni Newton harmadik. ha a molekula eléri a tárgyat, ki van téve az erő -F, ami a molekula „pattan” a falból. Ebben az esetben figyelembe vesszük az ütközés molekulák a fal teljesen rugalmas: a mechanikai energia a molekulák és a fal teljes mértékben megmarad, anélkül, hogy a belső energia a testek. Ez azt jelenti, hogy ütközés esetén változhat csak a sebesség a molekulák, és a molekulák és a fűtés a fal nem fordul elő.
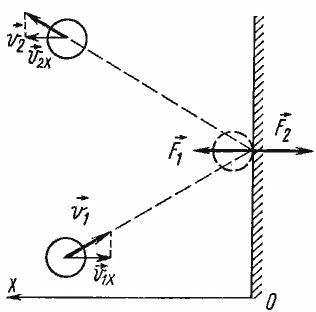
Annak ismeretében, hogy az ütközés a fal rugalmas, tudjuk megjósolni, hogy a molekulák sebessége változik az ütközés után. fokozatú ugyanaz marad, mint az ütközés előtt, és a haladási irány megfordul képest az x-tengely (vélem Oh - ez a tengely, amely merőleges a falra).
Gázmolekulák olyan sok, de kiszámíthatatlanul mozgó a falon és a hit gyakran. Keresse meg a pályája az az erő, amellyel az egyes molekula hat a falra, azt látjuk, a hatalom a gáznyomás. Ahhoz, hogy az átlagos sebesség a molekulák, statisztikai módszereket kell alkalmazni. Ezért alapegyenletének MKT használja az átlagos négyzetes molekulák sebessége, hanem a tér átlagsebesség: átlagos sebessége véletlenszerűen mozgó molekulák nulla, és nem kapott volna ebben az esetben nincs nyomás.
Most a fizikai jelentése az egyenlet: minél több a molekulák szereplő mennyiség, mint azok nehezebbek, és gyorsabb, mint a lépés - a nagyobb nyomást hoznak létre a falakon a hajó.
Alapegyenletének MKT az ideális gáz modell
Meg kell jegyezni, hogy az alapvető egyenlet a modell levezethető ICB ideális gáz vonatkozó feltételezések:
- Az ütközések a molekulák a környező tárgyak teljesen rugalmas. Az igazi gáz az azonos nem teljesen igaz; része a kinetikus energia a molekulák mindig bejut a belső energia a molekulák és a fal.
- Force kölcsönhatás a molekulák közötti elhanyagolható. Ha a tényleges gáz nagy nyomáson és viszonylag alacsony hőmérsékleten, ezek az erők válnak jelentős.
- Molekulák lényeges pontokon, figyelmen kívül hagyva a méretük. Azonban a tényleges méretei gázmolekulák befolyásolja a távolságot a molekulák és a fal.
- Végül alapegyenletének MKT tartja egységes gáz -, de a valóságban gyakran kell foglalkozni a gázkeverék. Példaként, a levegő.
Azonban a ritkított gáz ez az egyenlet ad nagyon pontos eredményt. Ráadásul sok reális gázok szobahőmérsékleten és nyomáson közel atmoszférikus, nagyon hasonlít a tökéletes gáz tulajdonságaira.
Mint ismeretes a törvények dinamikáját. a kinetikus energia egy szerv vagy egy részecske. Cseréje a termék tömegének az egyes részecskék és a tér a sebesség rögzített mi egyenletben, tudjuk bemutatni formájában:
Továbbá, a kinetikus energia a gáz molekulák képlete, amelyet gyakran használnak az alkalmazásokban. Itt k - Boltzmann állandó, ami megteremti a kapcsolatot a hőmérséklet és az energia. k = 1,38 • 10 -23 J / K.
Alapegyenletének MKT fekszik alapján termodinamika. Szintén használják a gyakorlatban a repülőgépipar, kriogéniának és neutronfizika.