A szerkezet a szénatomok
Jelenleg szerves kémia tekinteni, mint a Chemistry of Carbon Compounds, de adózván történetet még továbbra is hivatkozni rá a szerves kémiában. Ezért fontos, hogy mérlegelje részletesebben a szerkezet az elem az atom, a természet és a térbeli irányba képződött kémiai kötéseket.
szénatom áll egy magot, amelynek pozitív töltése +6 (mivel ez tartalmazza hat protonok), és az elektron-héj, amelyen hat elektronok elhelyezve két energiaszinten (rétegek):
A tényleges szerkezete szénatomos sokkal bonyolultabb, mint képviselt a diagramon.
Az a tény, hogy az „élő” a térben az elektron a mag körül van mind tulajdonságai, és a részecskék (tömege 1/1840 tömegének a proton vagy neutron), és a hullámhossz (képes megkerülni az akadályokat - diffrakciós, azzal jellemezve, hogy egy bizonyos amplitúdó, hullámhossz, a rezgési frekvencia és t. d.). Lehetetlen pontosan meghatározni a helyzetét az elektron a tér az atommag körül. Ezért beszélhetünk egy kisebb vagy nagyobb a valószínűsége a elektron egy adott régióban a tér. Ha tudnánk, hogy a kép egy atom, és a kép helyzetét az elektron lenne tükröződik a pontok formájában, akkor az alkalmazás egy hatalmas számú kép kapnánk egy képet az elektron felhő. Minél nagyobb a sűrűsége a felhő, annál valószínűbb az elektron ezen a területen. A tér a mag körül, amely abban rejlik, 90% az elektron felhő, az úgynevezett orbitális. Ez azt jelenti, hogy 90% -át az idő egy elektron, ebben a zárt térben. A jövőben meg fogjuk érteni az „orbitális” és a „felhő” egyenértékűnek.
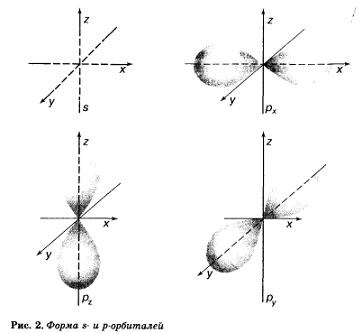
szénatomnak két fajta pályák I pályák gömb alakú, és p-pályák formájában súlyzók vagy ömlesztett nyolc (2. ábra).
Ezek a pályák különböznek egymástól nemcsak alakja, hanem a a sejtmag az atom. A távolabb az orbitális nucleus, annál több energiát van elektron pályák ezen. Az elektron energia - a legfontosabb jellemzője az állapota. Továbbá, és ami nagyon fontos, az energia az elektron az atom csak akkor fogadja el bizonyos értékeket, és az orbitális elektron elfoglalni egy bizonyos távolságra a sejtmagban. Ezek pályák különböznek árrés (szint) az energia.
Megkülönböztetni az energia szintjét, azok számozva sorrendben távolság a sejtmagban. A legközelebb a mag - az első (1), majd a második (2), stb ...
A szén-dioxid-szint az első I-pályáján-emelőt, amelyben van két elektront. A második energiaszintre szénatom is tartalmaz s-orbitális, de nagyobb, mint az energiaellátást a elektronok rajta nagyobb, mint az első elektron szinten, és három p pályák. Ez a súlyzó pályák az azonos méretű, amelyek kölcsönösen merőlegesek egymásra, mint a koordináta-tengelyek x, y és 2 (lásd. Ábra. 2). Minden orbitális fér két elektron, de ellentétes spin-értékeket.
Spin (angol pörögni -. Forgatás) - a belső mágneses momentuma az elektron (az fogalmának bevezetése a „spin” 1925-ben javasolta, hogy a mágneses tulajdonságait elektronok, mint a töltött részecskék által okozott forgása saját tengelye körül). A elektron spin csak akkor jelenik meg során kölcsönhatás más elektronok és a külső mágneses mező. Spin csak két érték - pozitív és negatív.
Bemutatni helyét az elektronok az atom, emlékeznünk kell arra, hogy minden egyes elektron foglal az energetikailag legkedvezőbb helyzetben, amelyben az értékesítésre az energia lesz a legkisebb. Mindig arra törekszik, hogy a legközelebb áll a lényege a helyzetet, és kap orbitális egyszerűbb formában (például először a s-, és akkor is csak a p-orbitális). Ha az egy szinten van több azonos kering-emelők, elektronok induláskor elhelyezett minden különálló orbitális azonos spin, és csak ezután párban, de ellenkező forog. Ennek megfelelően, a képlet E szénatom lesz formájában 1s 2s 2 2 2p 2.
Nagyon gyakran, a szerkezet a elektronhéjak atomok által megjelenített elektron diffrakcióval képletek. Ezek mindegyike orbitális jelöli az egy sejt által; mindegyik elektron - a nyíl; A nyíl irányába irányának felel meg a spin.
Azt ábrázolja elektron grafikus képletek szén- és hidrogénatomok.
A vegyérték a kémiai elem leggyakrabban száma határozza meg a párosítatlan elektront. szénatom, ahogy a elektron diffrakciós képletű, két párosítatlan elektront, így részvételük alkothat két elektron pár, hordozó két kovalens kötéssel. Azonban, szerves szén vegyületek nem két, de mindig négy vegyértékű. Ez lehet az a tény magyarázza, hogy a gerjesztett (pótlólagos energia) atom jön gőzöléssel 2 „elektronok, és az átmenet az egyik a 2p orbitális:
Egy ilyen atom négy párosítatlan elektront, és részt vehetnek a létrehozását a négy kovalens kötés.
Kovalens kötést képeznek, szükséges op-Bital egy atom orbitális átfedés a többi. Minél nagyobb az átfedés, annál erősebb a kapcsolat.
A hidrogén molekula H2 kovalens kötés kialakulása miatt következik be átfedés s-pályák (ábra. 3).
A távolság a atommagok hidrogén atom vagy egy kötés hossza 7,4 * 10 -2 nm, míg a szilárdsága - 435 kJ / mól.
Összehasonlításképpen: a molekulában egy fluor- F2 kovalens kötés jön létre az átfedés a két p pályák.
A kötés hossza Fluor-fluor egyenlő 14,2 • 10 -2 nm, és az erő (energia) kapcsolat - 154 kJ / mól.
A kémiai kötések eredményeként képződött az átfedés az elektron pályák a kommunikációs vonal mentén, az úgynevezett egy kötés (szigma-kötés).
kommunikációs vonal - összekötő egyenes atommagba. Az in-pályák átfedhetik csak az egyetlen módja - alkotnak egy kötést.
p pályák átfedhetik alkotnak egy kötést, és szintén átfedik egymást a két területen, kovalens kötést, hogy egy másik faj - miatt a „mellékhatások” átfedés:
A kémiai kötések eredményeként képződött a „oldalán” az elektron pályák átfedik kívül a vonal a kommunikáció, vagyis. E. két területen, az úgynevezett p-kötések (pi-kötés).
Tekinthető típusú kommunikációs jellemző C2H4 molekula etilén, acetilén, C2H2. De többet erről, megtudhatja a következő bekezdést.
1. Record képletű elektronikus szénatomos. Magyarázza a jelentését minden karakter benne.
Mik az elektronikus képlet bór, berillium és lítium?
Tedd elektron grafikus képletek megfelelő atomok ezen elemek.
2. Írja be az elektronikus képlet:
a) nátrium-atom és egy kation Na +;
b) a magnézium-kation Mg2 + atomot;
c) fluoratom, és az anion F -;
d) egy oxigénatomot és O 2- anion;
d) hidrogén ionok, H + és H-atom -.
Make-elektron pályák grafikus képletek az elektron-eloszlás ezekben a részecskék.
3. Az atom a kémiai elem megfelel a képletnek, E 1s 2 2s 2 2p 6?
Melyik kationok és anionok azonos e-képlet? Hogy az elektronikus-grafikai formula az atom és ezen ionok.
4. Hasonlítsd össze a hossza a kötések a molekula hidrogén és a fluor. Mi okozta a különbséget?
5. molekulák kétatomos nitrogén- és fluoratom. Hasonlítsuk össze a száma és a természet a kémiai kötések az atomok között őket.
Ha javításokat és javaslatokat a leckét, kérjük lépjen kapcsolatba velünk.
Ha azt szeretnénk, hogy a többi beállítást és javaslatokat órák, nézd meg itt - Oktatási fórum.