A konformáció globuláris fehérjék
A kifejezés konformáció alkalmazott proteinek leírására használt térbeli elrendezése (az összes vagy a kiválasztott részeit) a polipeptid-lánc, amely képes megváltoztatni a pozícióját térben törés nélkül kovalens csontváz miatt a szabad forgását körüli szén-szén kötést tartalmaz.
Másodlagos szerkezet - egy rendezett térbeli elrendezése (konformáció) az egyes részeinek a polipeptid lánc. Ez alkotja az áramkör a hidrogénkötések között peptid csoportok, azaz, imino között hidrogén és oxigén az karbonilcsoport. Másodlagos szerkezet szabályos struktúrák, mint például az a-hélix, b-hajtogatott rétegek, b-kanyar. Része a polipeptid lánc rendezett szerkezet, az ilyen területeket nevezzük amorf vagy strukturálatlan régiókban. Az egyik vagy a másik típusú másodlagos szerkezet határozza meg az elsődleges szerkezete alapján e polipeptid lánc része, és termodinamikailag a legkedvezőbb adott biológiai körülmények között.
a-helix jellemzi rendkívül sűrű a polipeptid lánc. Göndör Ridge polipeptidlánc formák egy rúd. Csoportok jelentése az aminosavak, kifelé fordítjuk, és ellentétes oldalain elhelyezett, a tengely (1.1 ábra).
Apoláris aminosavmaradékok gyökök általában csoportosítva egyik oldalán az A-hélix, amely egy nem poláros ív: ez megteremti a feltételeket a konvergencia a különböző helikális régiók. A természetes fehérjék is léteznek csak pravozakruchennye egy-hélix, amely által okozott jelenléte aminosavak fehérjék L-sorozat.
a-hélix stabilizáljuk hidrogénkötések között az oxigén előforduló karbonil-csoportok és a hidrogén-iminocsoportok található szomszédos menetei a hélix. Mindegyik karbonil-csoport alkot egy hidrogén-kötés a negyedik downstream NH- csoport. Az a-hélix hidrogén kötések mindegyike közelítőleg párhuzamos a hélix tengelyével. Képződésének kedvez a-hélix KLH, Ala, Leu. A részesedése spiralizált helyek fehérjék különböző. Így a polipeptid lánc mioglobin 80% képviseli formájában egy-hélix az inzulin spiralizált csak 50% a láncok, kimotripszin nem tartalmaz őket egyáltalán
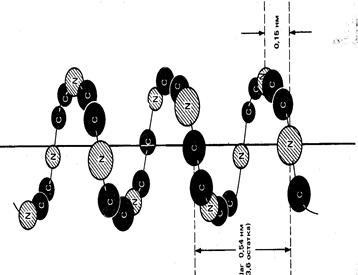
1.1 ábra Plot a-helikális fehérje szerkezetek
b-szerkezet. L.Poling kinyílt, és Corey egy másik megvalósítási módja szerint a periodikus struktúra, amelyeket az úgynevezett b-hajtogatott rétegek. Ez a kiviteli alak azzal jellemezhető, a másodlagos szerkezet. hogy van egy sima, nem pedig egy rúd formájában. A polipeptid-lánc redők b-szinte teljesen kitolt és ne csavarodjon meg szorosan, mint az a-hélix. Visszahajtott részek PPV inkább maradjon közel a fehérjemolekula alkotnak hajtogatott rétegek vagy szalag.
A legtöbb hajtogatott szerkezete tartalmazza kevesebb, mint 6 réteg. Szomszédos szakaszok hajtogatva TST rétegben azonos lehet a vektorba (párhuzamos b-réteg), vagy, hogy menjen ellentétes irányban (antiparallel b-réteg). Csoportok jelentése az aminosav-maradékok merőlegesek a réteg síkjára, ahol ezek a csoportok vannak orientált az egyik, majd a másik oldalon ennek a síknak. Képződése b-szerkezet megkönnyíti, például egy aminosav Met, Val, Gly, Pro.
b-hajlító - ez a fordulat PPT 180 fok. Ez alkotja hidrogénkötés eredményeként a kölcsönhatás az oxigén a karbonil-csoport az egyik maradékhoz, és a hidrogén-imino csoportjának másik aminosavval. Globuláris fehérjék egy zárt globuláris konformáció annak a ténynek köszönhető, hogy a PPC nem sok b-csavarják. A formáció a b-kanyarok hozzájárulnak a prolin aminosavat.
Amorf (nem-strukturált, rendezetlen régiók) olyan területek PPV jellemezve szabálytalan szerkezetű, amely szintén megtartja hidrogénkötések.
Supervtorichnaya szerkezet. a és b-helikális szerkezeti részek a fehérjék kölcsönhatásba léphet egymással, és egymással, alkotó együttesek. A térbeli szerkezet a együttesek úgynevezett szuper szekunder szerkezet vagy supervtorichnoy szerkezet. Például, - szupertekeredett egy-helix, amelyben két a-hélix van feltekercselve egyik a másik.
Tartományok. Ezek szerkezetileg és funkcionálisan különálló régió a molekula, egymáshoz kapcsolva rövid részeit a polipeptidlánc, amelyek úgynevezett csuklós részeket.
Harmadlagos szerkezet jellemzi a térbeli elrendezése és rendezett amorf területeken általában PPV, azaz leírja a térbeli csomagolás (konformáció) az egész fehérjemolekula, ha bemutatják a PPV. A harmadlagos szerkezet miatt a konvergencia és reakciómaradványokban gyökök egymástól távol a lineáris szekvenciája PPV.
Globuláris fehérjék jellemzi kompakt csomagolás PPV. Így gyökök nem poláros aminosavak, amelyeknek nincs affinitása a vízhez, lokalizált főleg belül a gömböcske és formáját egy vagy több hidrofób régiók (magok) középpontjában a protein gömböcskék. A legtöbb poláros gyökök felületén jelen lévő a gömböcskék a hidratált állapotban, és felé néz a vizes környezetben. A felszínen a gömböcskék is lehet kis mennyiségű nem-poláros gyökök, ahol azok felhalmozódását, amelyek egy hidrofób klaszterek vagy „ragadós” zónában. Így a teljes felülete a fehérje gömböcske mozaik: alapvetően hidrofil, de tartalmaz és apoláros részeket.
Stabilizálja a harmadlagos szerkezetét az alábbi linkeken:
1 kovalens kötés (diszulfid)
a) hidrofób kötések
b) hidrogénkötések
1. A diszulfid-kötés (diszulfidhíd) kölcsönhatásából képződik a (oxidáció) SH csoportok cisz gyökök azonos polipeptid-lánc (láncon belüli diszulfid-kötés), vagy a különböző polipeptid-láncot (a láncok közötti diszulfidhíd).
A nem kovalens kötések, specifikus fehérje-molekulák.
1. hidrofób kölcsönhatás az egymáshoz közeli hidrofób (nem poláros) aminosav-gyökök maradékok (Ala, Val, Leu, Ile, három, hajszárító, pro, gly, met). (1.2 ábra)
2. A sót vagy ionos kötések fordulnak elő az oldalsó csoportok jelentése az aminosav-oldalláncból ellentétes töltések disszociációja miatt a karboxilcsoport és protonálódása az aminocsoportok. Mivel az alap (pozitív töltésű) csoport hathatnak e-amino-csoportja, Lys, Arg guanidino-csoport, imidazol-csoport GIS (az egyik a nitrogénatomok az imidazol-csoport bázikus tulajdonságokkal rendelkezik, egyéb - sav). Hisztidin hozzáadása mellett, mint egy savas (negatív töltésű csoportok) végző szabad karboxil-csoportok, az Asp és Glu.
A natív konformáció a legtöbb energetikailag kedvező állapot. A harmadlagos szerkezet által meghatározott elsődleges szerkezetét PPV így beszélhetünk a genetikai determinizmus harmadlagos szerkezetét.
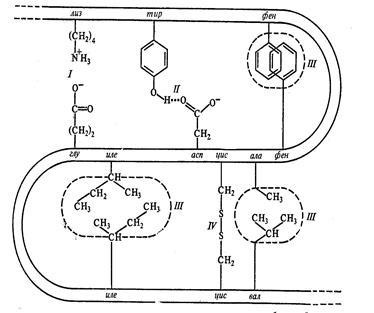
Ábra. 1.2 Kommunikációs harmadlagos szerkezetének stabilizálásával a fehérje. I - ionos kötéssel, II - hidrogén kötés, III - hidrofób kötések, NE - diszulfid-kötés.
Kvaterner struktu leírja a relatív orientációját két vagy több PPT fehérjemolekula szintetizált függetlenül. Fehérjék negyedleges szerkezet úgynevezett oligomerek, és az őket alkotó polipeptid-láncból - promoterok vagy alegységek. Alegység esetében az oligomer fehérje lehet azonos vagy különböző. Van egy betűjelet, leggyakrabban az oligomerek tartalmaz páros számú protomerek. A negyedleges szerkezet függ az elsődleges, másodlagos és harmadlagos szerkezet az azt alkotó alegységek. Formation of a kvaterner szerkezete a önálló összeszerelés történt bevonása nélkül enzimek.
A kvaterner szerkezet stabilizálódik nagyrészt hidrofób kötések, jelenléte miatt a felszínen a hidrofób alegységek „ragadós” zónákat. Fehérjék kvaterner szerkezetű hemoglobin (négy alegységből), immunglobulinok (két könnyű és két nehéz láncot), kontraktilis fehérje miozin (nehéz és 2 könnyű láncból 4). Az enzimek kvaterner szerkezetének működnek különös szabályozási funkció.
A jelenléte nagyszámú különböző oligomer fehérjék a sejten belül csökkenti ozmolalitást és viszkozitás abban. Az oligomer proteinek jól szabályozottak különböző effektorok. A biológiai jelentősége oligomer proteinek is társítva van az a tény, hogy a genetikai kódolás kevesebb anyagot igényel, ha néhány vagy az összes alegység molekulák azonosak. Mi oligomer proteinek, hogy kisebb a valószínűsége a hibás molekulák.