A szerkezet és életciklusa a humán immundeficiencia vírus (HIV) - a vírusok - katalógus
A szerkezet a humán immundeficiencia vírus
HIV virionok a gömb alakú részecskék formájában, amelynek átmérője körülbelül 100-120 nanométer (ez körülbelül 60-szer kisebb, mint az átmérője egy eritrocita).
A szerkezet a érett virion áll, több ezer fehérjemolekulák különböző típusú.
Belül a kapszid egy fehérje-DNS komplexek: a két szál a virális RNS, de erősen kötünk egy nukleokapszid fehérjét P7, enzimek (reverz transzkriptáz, proteáz, integráz).
Mivel kapszid proteinek szintén a kapcsolódó Nef és Vif (7-20 Vif molekulák per virion).
Bent a virion (és valószínűleg kívül kapszid) található fehérje Vpr8-11. Továbbá, a kapszid a HIV-1 (de nem a HIV-2) svyazazny körülbelül 200 példányban peptidilprolilizomerazy celluláris enzim szükséges virion szerelvény.
A lipid membrán integrált glikoprotein komplex 72 Env. amelyek mindegyike által alkotott három molekula gp41 transzmembrán-glikoprotein (TM), alkalmazottja „horgony” komplex, és három molekula felszíni glikoprotein gp120 (SU).
Segítségével a protein gp 120 vírus tulajdonít a CD4 receptor és koreceptort. felszínén található T-limfociták. A sztöchiometriai arány a p24: gp120 a virion 60-100: 1.
A fehérjéket gp41 és gp120 különösen intenzíven tanulmányozott potenciális célpontként fejlesztésére gyógyszerek és oltóanyagok HIV ellen.
Amikor alkotó a külső héj a vírus, mint egy befogó bizonyos mennyiségű sejt membrán proteinek, beleértve a humán leukocita antigének (HLA) I. osztályú és II molekulák és a tapadás.
Funkciók fontos szerkezeti fehérje a HIV-1
A HIV genetikai anyag által képviselt két példányban a pozitív-szensz (+) RNS-t. Gene HIV-1 hossza 9000 nukleotid. A végén a genom által képviselt hosszú terminális ismétlődést (Eng. Hosszú terminális ismétlődő, LTR), amelyek szabályozzák a termelés az új vírusok és lehet aktiválni, és a vírus fehérjék, és proteinek a fertőzött sejtben. 9 HIV-1 kódoló gének legalább 15 fehérjék.
A gén pol kódol enzimek: a reverz transzkriptáz (RT), integráz (IN) és a proteáz (PR).
Gag gén egy poliproteint kódol Gag / p55, virális proteáz hasítási strukturális proteinekkel P6, P7, P17, p24.
Env-gén kódolja a fehérje gp160, hasítási sejt endoproteáz furin strukturális proteinek gp41 és gp120.
A többi hat gén - tat, rev, nef, vif, vpr, vpu (VPX HIV-2) - felelős proteineket kódolják, hogy a HlV-1-sejtek fertőzésére és olyan új másolatokat a vírus. A HIV-1 in vitro nélkül lehetséges gének nef, vif, vpr, vpu, de a termékek szükséges a teljes fertőzés in vivo.
Gag: poliprotein prekurzor Gag / p55 szintetizálódik teljes hosszúságú genomi RNS-t (ami ebben az esetben szolgál mRNS) a folyamat a szabványos lámpafej-függő transzláció, de legyen elérhető, és IRES-függő transzláció. Prekurzorai funkcionális fehérjék a poliprotein vannak elrendezve az alkatrész Gag / p55 a következő: p17, ... p24 ... P2 ... P7 ... p1 ... P6 (a P1 és P2 - peptidek kapcsolására; más Gag / p55 hasítási termékek a fent leírt).
Nem bomlott proteáz Gag / p55 három fő domént: egy membránt lokalizációs doménjét (M, membrán célzás), a kölcsönhatás domént (I, interakció) és a „késői” domén (L, késői).
Domain M belsejében elhelyezett területén p17 / MA miristiliruetsya (maradékok csatlakozott mirisztinsav), és elküldi Gag / p55 transzlokációját a plazmamembrán. Domain I, a területen belül a P7 / NC, felelős intermolekuláris kölcsönhatás egyedi monomerek Gag / p55. Domain L, szintén lokalizálódik a P7 / NC, közvetíti virionok kidudorodása a plazma membrán; Ez a folyamat is részt p6 doménjével poliprotein Gag / p55.
Vpu: Két fontos funkciója Vpu fehérje:
1) megsemmisítése a sejt receptor CD4 az endoplazmatikus retikulumban vonzása révén ubiquitin ligáz komplexek
2) stimulálása leányvállalata kiosztási virionok sejtekből inaktiválásával Az interferon által indukált transzmembrán fehérjét CD317 / BST-2, amely megkapta a nevét «tetherin» a képességét, hogy gátolják a kiválasztási újonnan alakult lánya virionokat retenciós a sejt felszínén.
Vpr: Vpr fehérje esszenciális a virális replikációhoz a nem osztódó sejtek, beleértve a makrofágok. Ez a fehérje, valamint más celluláris és virális fehérjék, aktiválja a hosszú terminális ismétlődéseit a HIV-genom. Vpr fehérje fontos szerepet játszik az átadása provírusban a sejtmagba, és okoz késedelmet a sejtosztódás időszak G2.
Vif: Vif fehérje fontos szerepet játszik támogatásában vírus replikáció. Törzsek mentes a fehérje nem replikálódik a CD4 + limfociták, néhány sor a T-limfociták ( „elérhetetlen sejtek”) és a makrofágok. Ezek a törzsek képesek behatolni a célsejtekbe, és kezdeményezi reverz transzkripciójával provirális DNS-szintézist, de befejezetlen marad.
Nef Nef több funkcióval rendelkezik. Gátolja a CD4 kifejeződése és a HLA molekulák I. osztályú és II felszínén fertőzött sejtek, és így lehetővé teszi, hogy a vírus, hogy elkerülje a támadás a citotoxikus T-limfociták és CD4 + limfociták által felismerés. Nef fehérje szintén gátolják a T-limfociták, a különböző kötőfehérjék komponenseit intracelluláris jelátviteli rendszerek.
A HIV-fertőzött Rhesus makákók aktív vírus replikációjával és a betegség progressziója csak akkor lehetséges, ép nef gént. Törlése a nef gén találtak törzsek HIV-izolátumokból származó csoport ausztrál hosszú távú, nem-progresszív során a fertőzés.
Azonban néhány közülük idővel, voltak jelei a betegség előrehaladását, többek között csökkenti a CD4 + limfociták. Így, bár törlését a nef gén lassíthatja a virális replikációt, nem garantálja a teljes lehetetlensége a betegség progresszióját.
Tat és Rev: szabályozó proteinek Tat (transz-aktivátor) és Rev felhalmozódik a sejtmagban, és kötődnek meghatározott részeinek a virális RNS-t. Tat-protein molekulatömege körülbelül 14-15 kD, kötődik a másodlagos szerkezete genomiális RNS közelében az 5'-nem transzlatált régió aktiválja a HIV reverz transzkripciójával genomiális RNS virális mRNS-szintézist, és szükséges a virális replikációhoz szinte minden sejttenyészetekben, szabályozza a kimeneti virionok a fertőzött sejtekből szükséges celluláris kofaktor - ciklin T1. Rev fehérje expresszióját szabályozza, a fehérjék a virion kötődik mRNS env gént RRE (Eng. Rev. válasz elemet) intron exon Split gének Tat és Rev.
Tat és Rev fehérjék serkentik transzkripcióját provirális DNS-t és RNS-t a közlekedés a sejtmagból a citoplazmába, és szintén szükséges fordítási. Rev protein transzfert is biztosít a virális komponenseket és az alapvető kapcsolóüzemű szabályozó vírus fúziós fehérje strukturális szintézist.
A diagram azt mutatja, virriona HIV fúziós és a plazma membrán a humán T-limfocita
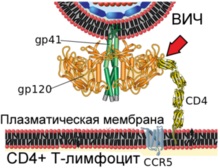
1. lépés kölcsönhatása a virális fehérje gp120 a CD4 celluláris receptorral (jelzett piros nyíl)
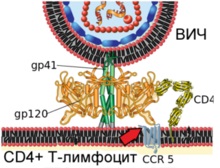
2. lépés A konformációs változás a virális fehérje gp120 kötődést mediálják a celluláris receptorhoz CCR5 (jelzett piros nyíl)
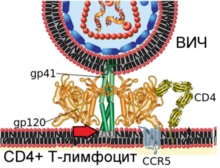
3. lépés végrészei virális fehérje gp41 behatolnak a plazmamembrán a sejt (tényét a piros nyíl)
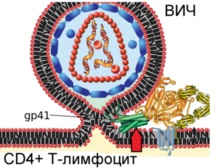
4. lépés: a virális gp41 fehérje megy keresztül jelentős konformációs változások, félbehajtva (tényét a piros nyíl), és alkot egy spirális, amely elvezet a konvergencia és a fúziós a virion és a sejt membránok. Így méri HIV T-sejt számára az azt követő szaporodásra.
Behatolását a sejtbe és integráció
Vírusfertőzés kezdődik, amikor a HIV-virion szembesül emberi sejt, amelynek a membrán receptorai CD4. Vírusos glikoprotein gp120 kötődik szorosan a CD4 receptorhoz. Ennek eredményeként a kölcsönhatás azt konformációs változáson megy át a gp120-ban, amely lehetővé teszi azt is, hogy egy olyan molekulát kötnek, vagy CXCR4 koreceptor CCR5 (kifejezve a T limfociták felületén, makrofágok, dendritikus sejtek és mikroglia).
Attól függően, hogy a képességét, hogy kötődni koreceptorokként HIV besorolása R5-tropikus (csak akkor kötődik CCR5), X4-tropikus (csak köti CXCR4) és R5X4-tropikus (kölcsönhatásba léphetnek mind ko-receptorok). Gyógyszerek, amelyek blokkolják koreceptorait HIV-ellen hatékony.
Ezek után a sejtmembrán és a membrán HIV virion egyesítés, és a tartalmát a virion belép a sejtbe. Fehérje gp41 fontos a membrán fúzió, így ez tekinthető a cél a fejlesztés a vírusellenes gyógyszereket. A sejtek belsejében a virális RNS felszabadul a kapszid, és a reverz transzkripció történik - a DNS-szintézis alapján egyszálú templát genomiális RNS katalizált reverz transzkriptáz.
A legtöbb kábítószer használatra jóváhagyott HIV-fertőzés, célja a zavar a reverz transzkriptáz. A szintetizált DNS-t szállítanak a sejtmagba, és integrálódik a gazdasejt kromoszómájába hatására integráz. Számos gátló gyógyszerek integráz korai stádiumú klinikai vizsgálatokban. A virális DNS integrálódik a kromoszómába a sejt, úgynevezett provírus.
Humán RNS-polimeráz a sejtmagban szintetizálnak hírvivő RNS (mRNS), és később, a genomiális RNS-vírus. A szintetizált RNS szállítják vissza a citoplazmába, ahol a mátrix a-mRNS riboszómákon szintetizált virális enzimek, strukturális és szabályozó fehérjék.
Szerelés és bimbózó virionok
A genomiális virális RNS és virális fehérjék szállítják a helyeit virion szerelvény. virion összeszerelés zajlik a membrán, amely megkapja miristilirovanny poliprotein Gag / p55. Virionok eredetileg kialakítva prekurzor poliproteinek szerkezeti fehérjék és enzimek és ebben a szakaszban nem fertőzőek.
Érése közben a vírusrészecske virális proteáz hasítja a prekurzor protein a funkcionális elemek. Néhány jóváhagyott vírusellenes gyógyszerek gátolják a proteáz munkát, és megakadályozza az érett virionok.
Új vírus részecskék rügy a sejtfelszínről, elfog részét membrán, és ki a véráramba, és a gazdasejt receptort hordozó CD4, meghal. A legújabb kutatások kimutatták, hogy a folyamat kezdő virionok lehet bonyolultabb, mint azt korábban gondolták. Így azt találtuk, hogy a Gag-protein kölcsönhatásban a komponenseket a virionok sejtekből felhalmozódnak specifikus intracelluláris multivezikuláris szervek, amelyeket általában használnak a kiviteli fehérjék. Így a vírus részecskék szabadulnak fel a sejtekből kihasználásával saját makromolekulák közlekedési rendszer.
A terjedését a szervezetben
Akut fázisában a HIV-fertőzés hiányában specifikus immunválaszt teszi lehetővé a vírus replikálódni és aktívan eléri a magas koncentráció a vérben.
A vírus megfertőzi szervek a nyirokrendszer, a CD4 + limfociták, CD8 + limfociták és makrofágok és más sejtek: alveoláris makrofágok a tüdő, Langerhans-sejtek, follikuláris dendritikus sejtek a nyirokcsomók, oligodendrogliasejtek sejtek és az asztrociták az agy és a bél epiteliális sejtekben.
A nyirokszövet HIV szaporodik az egész betegség, érintő makrofágok aktiválódnak és nyugalmi CD4 + limfociták és a follikuláris dendritikus sejtek. Tartalmazó sejtek számának provirális DNS a nyirokszövet 5-10-szer nagyobb, mint a vérsejtek, és a HIV-replikációt limfoid szövetben 1-2 nagyságrenddel nagyobb, mint a vérben.
HIV tározó a nyirokcsomók, és specifikusan dendritnye sejtekben, amelyekben a vírus fennáll sokáig időszak után az akut virémia.
Hogy aktiválja a CD8 + limfociták és a kialakulása egy antigén-specifikus citotoxikus T-limfociták számára szükséges bemutatása peptid antigént kombinálva humán leukocita antigén I. osztályú
A dendritikus sejtek neobhodimye iniciálására primer antigén-specifikus válaszok, antigének feldolgozása és expresszálódik a sejt felszínén, ahol ezek az antigének együtt ko-stimulátor molekulák aktiválják a T-limfociták.
A fertőzött sejtek gyakran szekretálnak-kostimuláló molekulákat és ezért nem képes okozni aktiválását elegendő számú B- és T-limfociták, amelyek a funkció függ a dendritikus sejtek.
Befejezése után a reverz transzkripció, a CD4 + -limfotsite virális genom tartalmazza a nem-integrált provirális DNS. Az integráció a HIV DNS-nek a gazdasejt genomjába, és így új vírus igényel aktiválása a T-limfociták.
Kapcsolat CD4 + limfociták és antigénprezentáló sejtek limfoid szövetekben, vírusok felszínén a follikuláris dendritikus sejtek, és a jelenléte gyulladáskeltő citokinek (IL-1, IL-6, és a TNFa) elősegítik proliferációját HIV a fertőzött sejtekben. Ezért nyirokszövete fejezi ki az optimális környezetet a HIV replikáció.
Ezen túlmenően, ez a módszer is hatékonynak bizonyult a fertőzés megelőzésére a nem fertőzött sejtek. A fenti megközelítés vezethet a fejlesztési módon lehet teljes szabadulást a HIV-fertőzést.