Konjugált rendszerek 1
Lokális és delokalizált kötések.
A kovalens kötés lehet lokalizálni és delokalizált. Lokalizált hívás kapcsolatot, az elektronokra, amelyek megoszlanak a két mag kötési atom.
Azokban az esetekben, ahol a kötő elektronok között oszlanak meg több mint két mag, beszélni a delokalizált kötések. Delokalizált kötést - jelentése kovalens kötés, molekulapályák amely több mint két atom. A legfontosabb tényező, amely meghatározza a kémiai tulajdonságai molekulák, az eloszlása az elektronsűrűség benne. A természet az eloszlás függ a kölcsönös hatása tartalmaz.
A párosítás áll rendelkezésre sok szerves molekulák vegyületek (alkadiének, aromás szénhidrogének, karbonsav, karbamid, stb). konjugációs rendszer lehet zárt vagy nyitott, és tartalmazhat nemcsak szénatomok hanem heteroatomot: Cl, O, N, S és munkatársai (akrolein, akrilnitril, piridin).
A nyílt interfész rendszer
Például, egy egyszerű nyitott kapcsolatban konjugációs rendszerrel, amely csak szénatom, például 1,3-butadién.
Mind a négy szénatomot tartalmaznak molekulánként 1,3-butadién vannak sp2 hibridizációs. Mindezek atomok egy síkban fekszik és a forma # 963; -skelet molekula. 5. ábra.
A nem hibridizált p - pályák minden szénatom található erre a síkra merőleges, és egymással párhuzamosan. Ez megteremti a feltételeket a kölcsönös átfedés. A átfedése pályák történik nem csak a szénatomok között a C-1 és C-2 és C-3 és C-4, hanem részben a szénatomok között a C-2 és C-3 (ris.5b). Amikor átfedő négy pz pályák vannak kialakítva egyetlen π-elektron felhő, azaz párosítás két kettős kötést.
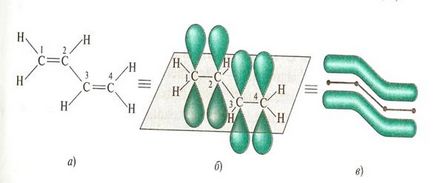
Ez a fajta interfész hívják π, π-konjugáció, azaz a. Ahhoz, hogy kölcsönhatásba pályák π-kötések. kapcsolási áramkör tartalmazhat nagyszámú kettős kötések. Minél tovább, annál delokalizáció π-elektronok, és a stabilabb a molekula. A konjugált π-elektron rendszer nem már tulajdonában lévő bizonyos kapcsolatokat, azaz, ha azok delokalizált. E. egyenletesen oszlanak el a teljes molekula. Delokalizációja π-elektronok a konjugált rendszer kíséri energia felszabadulása nevezik az energia a párosítás. Az ilyen molekulák sokkal stabilabbak, mint rendszerek izolált kettős kötéseket.
Ennek oka az, hogy az energia az ilyen molekulák alább. Ennek eredményeként a delokalizációja elektronok képződése során a konjugált rendszer részlegesen igazítás kötéshosszak: odinarnayastanovitsya rövidebb, és a dupla-hosszú.
Szénhidrogének nagy számú konjugált kettős kötések eloszlása a növényvilágban. Ezek közé tartozik, például, a karotinoidok felelősek a színe sárgarépa, paradicsom, olaj, stb
A második típus sopryazheniya- p, π-konjugáció. A p, π-konjugált rendszerek párosítás formáció részt atom egy osztatlan elektronpárt donor p. Ez lehet :. Cl, O, N, S, stb Ezek a vegyületek közé tartoznak a halogenidek, észterek, acetamidok, karbokationok. A molekulák ezen vegyületek végzik konjugációja a kettős kötés a p-orbitális heteroatomot. Delokalizált három-központ kötés jön létre az átfedés a két p pályák -gibridizovannyh sp2 szénatom és egy p orbitális elektron pár heteroatomot.
Minden a szénatomok, a benzol molekula vannak sp2 hibridizációs. Hat SP-hibrid felhő formájában benzolt csontváz.
minden # 963; -bond (C - C és C-H) egy síkban fekszik. Hat negidridizovannyh p-pályák síkjára merőleges a molekula vannak elrendezve egymással párhuzamosan. Minden p-orbitális ugyanígy átfedésben a két szomszédos p-pályák. Ennek eredményeként az átfedés van egy egyetlen delokalizált π-rendszer, a legnagyobb elektronsűrűségű, amely alatt és felett a sík # 963; -skeleta és lefedi a szénatomok a ciklus. π-elektron sűrűség egyenletesen eloszlik a teljes gyűrűrendszer. Minden kötések szénatomok közötti egyenlő hosszúak (0,139 nm), közbenső hosszai közötti egyszeres és kettős kötések.
A heterociklusos aromás vegyületek előfordul mindkét típusú sopryazheniyaπ, π-konjugáció és p, π-konjugáció.
π, π-konjugáció aromás heterociklusos vegyületek jellemző hattagú heterociklusos vegyületek. Például, a piridin és pirimidin
PirroiCH Furán Tiofén
Aromásság - olyan kifejezés, amely magában foglalja a különböző tulajdonságainak aromások, bevezette a német fizikus E. Hückel (1931).
Egy különleges tulajdonsága bizonyos kémiai anyagok, ahol a kettős gyűrű telítetlen kötések mutatnak rendellenesen nagy stabilitás; nagyobb, mint ami akkor várható, csak az egyik párosítás. Aromásság nem kapcsolódik közvetlenül a szag szerves vegyületek, és egy olyan koncepció, amely leírja a összessége strukturális és energetikai tulajdonságait néhány gyűrűs tartalmazó molekulák rendszer konjugált kettős kötések. Az „aromás rész” javasolták, mert az első képviselői ennek a csoportnak az anyagok kellemes illatú. Aromás vegyületek egy nagy csoportja molekulák és ionok különböző épületek, amelyek megfelelnek a kritériumoknak aromatikusságának.
1. Lapos zárt hurokban.
2. Minden C atomok sp 2 - hibridizáció
3. Megfelel Hückel szabály: meg, tartalmazza az a gyűrű (4n + 2) p-elektronok, ahol n = 0,1,2,3 ...
4. az egyetlen, a konjugált rendszer, - vagy p, π-elektronok.
5. Jellemző elektrofil szubsztitúciós reakció-SE.
6. ellenálló oxidálószerek.
7. Rendelkeznek termodinamikai stabilitása.
A molekula egy szerves vegyület aggregátuma atomokból egy bizonyos sorrendben a kovalens kötés. Így kötésű atomjai változhat nagyságú elektronegativitási (EO).
Elektronegativitás - képessége egy atom, hogy vonzzák a elektron sűrűség, hogy egy másik atom egy kémiai kötés.
Minél nagyobb az értéke EO ez az elem, annál inkább vonzza az elektronokat kommunikáció. Az érték az EO hozta létre az amerikai kémikus L. Pauling és ez a sorozat az úgynevezett skálán Pauling.
EO szénatom állapotától függ annak hibridizáláshoz szénatomot az különböző típusú hibridizációs különböztetjük meg egymástól, EO és ez attól függ aránya s-felhő formájában hibridizáció. Például, a C-atom képes sp3 -hybridization a legkisebb EO mivel a részesedése a p-felhő esik a legkevésbé s-felhők. több EO C atom SP-hibridizáció.
Minden alkotó atomok a molekula vannak összekapcsolva egymással, és interferenciát. Ezt a hatást át kovalens kötéssel elektronikus hatásokat.
Az egyik a tulajdonságok a kovalens kötés egy bizonyos mobilitása az elektronsűrűség. Ő képes mozgatni az irányt az atom nagyobb EO
A polaritás a kovalens kötés - egy egyenetlen eloszlása elektronsűrűség közötti ragasztott atomok.
A poláris kötés a molekulában befolyásolja az állam a szomszédos linkeket. Ezek befolyásolják a poláris kötés, és az elektronsűrűség trend az több EO atom ,. e., az elektron transzfer hatás.
Az elmozdulás a elektronsűrűség a lánc mentén # 963; -kötéseken nevezett indukciós hatása, és jelöljük az I.
Induktív hatása átadódik az áramkör a csillapítás, azaz. K. A formáció # 963; -bond, nagy mennyiségű energiát, és ez rosszul polarizált, ezért az indukciós hatás még kifejezettebb egy, kettő kapcsolatokat. az elmozdulás iránya az elektronsűrűség # 963; -kötéseken jelölésére egyenes nyilak →;
E.O.atoma Cl> EO C atomok
EO hidroxil-csoport OH> EO C atomok
Az atom vagy atomcsoport, előfeszítő az elektronsűrűség # 963; -bond a szénatom a nevezett elektronoaktseptornymizamestitelyami és mutatnak negatív indukciós hatásának (-I- hatás).
Ezek halogének (Cl, Br, I), OH -. NH2 -. COOH, COH, NO2. -SO3H és mtsai.
Az atom vagy atomcsoport, említett donor elektronsűrűség és az elektrondonor szubsztituensek kifejtett pozitív indukciós hatása (+ I- hatás). + I-effektproyavlyayut alifás szénhidrogéncsoportok CH3. C2 H5 és mtsai.
Induktív hatása megnyilvánul, ha a kapcsolódó szénatomok megkülönböztetve hibridizáció. Például, egy olyan molekula, propén CH2 = CH-CH 3 CH 3-csoport mutat + I-hatás, mint egy szénatommal rendelkeznek, egy sp3 -Hybrid állapotban, és a szénatomok a kettős kötés a sp2 -Hybrid állam és mutatnak egy nagy elektronegativitása, így -I-hatását mutatja, és elektron akceptor.
mezomorf hatást
Mezomorf hatást. Ellentétben nem konjugált vegyületek, amelyekben az elektronikus hatását szubsztituensek a továbbított # 963; -bond (induktív hatás), a konjugált rendszerek a transzmissziós elektronmikroszkópos hatását játszanak a legfontosabb szerepe a delokalizált π-elektronok a kovalens kötés. A hatás nyilvánul meg eltolódását elektronsűrűség delokalizált (konjugált) L-rendszer hívás mezomer (M-hatás), vagy a hatás konjugáció.
Mezomer hatása - a átadása elektronikus hatása szubsztituenseket a konjugált rendszer.
Ugyanakkor a helyettes maga is tagja a konjugált rendszer. Ez lehet, hogy a rendszer interfész π-kötés (karbonil-, karboxil- és más csoportok), a magányos elektronpár heteroatomot (halogénatom, amino- és hidroxi), egy üres vagy töltött egy vagy két elektron p-AO.
A szubsztituensek, amelyek növelik az elektronsűrűség a konjugált rendszer, kifejtett pozitív mezomer hatása (M +)
+M -effect szubsztituenseket tartalmazó alkilcsoport, amelynek osztatlan elektronpárt vagy egy negatív töltés. Ezek a szubsztituensek képesek átvinni egy elektronpár a teljes konjugált rendszer, azaz. E. elektrondonor jellegű.
Szubsztituensek, amelyek csökkentik az elektronsűrűséget a konjugált rendszer, mutatnak negatív mezomer hatása (-M).
(-M) -effect szubsztituenseket tartalmazó kettős kötéseket és a pozitív töltésű atomok, m. E. elektronszívó szubsztituenseket.
Grafikusan, az elmozdulás a elektronsűrűség jelzi ívelt nyilak, az elején, amely azt mutatja, hogyan p vagy π-elektronok kényszerült, és a végén - egy kötés, vagy az atomokkal, amelyekhez kényszerült. Ellentétben induktív, mezomorf hatást visz át a rendszer konjugált kötések sokkal nagyobb távolság.
A következő példák azt mutatják, a megnyilvánulása - N- hatása a karbonilcsoport a benzaldehid és az akrolein (π, π-konjugáció),
és a + M hatása az aminocsoport a anilin (p, π- konjugáció).
3. táblázat szubsztituensek elektronikus hatásokat
