Vanádium-oxidok - kémiai enciklopédia
VANADIUM-OXIDOK. Műszaki adatok naib. Fontos vanádium-oxidokat mutatunk be a táblázatban. Az oxidációs állapot V növekedésével az oxidok savas oxidjai növekszenek. valamint vegyi összetételüket. ellenállás. Sok vanádium-oxid esetében meglehetősen széles homogenitású régiók jellemzőek (lásd a táblázatot és a ábrát).
A monoxid VO nem oldódik fel. a vízben; a razb-vel. szervetlen sók. A k-tami halványkék vagy ibolyaszínű (V) általános képletű sókat képez. Erős redukálószer. A V2O5 hidrogénnel történő csökkentésével 1700 ° C hőmérsékleten nyerhető. Hidroxid V (OH) 2. amelyet a V (II) p-p-sók lúgainak hatására képzünk, egyedi formában nem kapjuk meg.
A Sesquioxide V2 O3 két kristályos. módosításokat; - 105 ° -on. (1,8 kJ / mol átmenet), az alak antiferromágnes. Neel úr 168 K. A vízben nem szabad; Inorgban. A k-tami a V (III) általános képletű sókat képezi. Erős redukálószer. A V2O5 szénmonoxiddal történő redukciójával nyerhető. H2. S, stb. Vanádium bronz készítéséhez. mint a termisztorok anyaga. Karelianit ásvány formájában jelenik meg a természetben. A hidroxid V (OH) 3 alkáli vagy ammónium-hidroxid hatására képződik a V (III) sók oldatainak levegőhöz való hozzáférése nélkül.
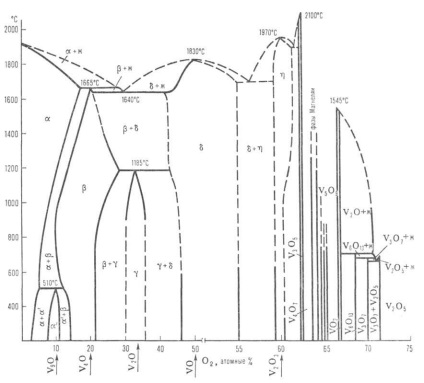
A vanádium-oxigén rendszer állapotának diagramja: M-olvadék; - szilárd oldatok (V2O-alapú - V2O-alapú - V2O-alapú - V2O alapú - V2O-alapú - V2O3 alapú - V2O3 alapú - V9O-alapú V9O-alapú); A szaggatott vonalak jelzik a fázisok közelítő határait.
A Trivanadium Pentaoxid V3O5 antiferromágnes. Mr. Neel 270 K; a 430 K-on fémes lesz. vezetőképesség.
A VO2-dioxid két kristályos anyagban létezik. módosításokat; 68 ° C-on. (átmenet 3,1 kJ / mol), az alak egy antiferromágnes. Dr. Neel 345 K. Nem oldódó. a vízben. Nedvszívó. Az amfoterén savas vanadil kation VO 2+ -ot képez savas régiókban (p-p világoskék színt kap), vanadátokat (IV) adnak lúgos oldatokban, a sót nem izolálják a szőlőben. az izopolivanedium (IV) k-h H2 V4 O9 állapotát. Helyreállítási anyag. Levegővel oxidálva. A V2O5 oxálsavval való fúziójával kapott levegőt levegő nélkül, a V2O3 és a V2O5 keverékével végezzük. a V2O3 oxidációjával. Alkalmazva vanádium bronzok előállítására. mint termisztorok félvezető anyaga, memória elemek, kijelzők stb. kapcsolói.
Hidroxid VO (OH) 2 - rózsaszínű kristályok; a pórusok pH-ja 4-nél nagyobb mértékben kicsapódott. Amfoterén.
A 700 ° C feletti Pentaoxid divanadium V2O5 disszociálódik. A diamágneses. N típusú félvezető; zenekari rés
2,5 eV. A víz víztartalma 25 ° C-on 0,35 g / l; vizes oldatokban van egy izopolymanális (V) k-es valószínű összetétel H2 [O (V2O5) 2,5] formájában. Savas p-rax valószínű - a létezés V (V) ionokat VO2 + és VO 3 +. A terheléssel. Az ilyen hidrátok (pH 1-2) változó összetételű V2O5 * xH2O-val hidratálódnak. A vanadátumok (V) lúgos oldatokban vannak. A technikai V2 O5 előállításához lásd: Vanádium. A Pure V2O5-t úgy állítjuk elő, hogy az NH4 VO3-at 400-500 ° C-on lebontjuk az utóbbival. áztassa az O2 sugárban. a VOC13 hidrolízise. A pentaoxid egy köztitermék. termék a ferrovanadium, vanádium gyártásánál. vanadátumok és egyéb vegyületek. V; katalizátor H2S04 előállításához; komponens specifikáció. szemüvegek, mázok és a piros fény lumineszcenciája. Természetben ásványi schungait formájában fordul elő.
T. b. - 3000 ° C (bomlik). ** T. b.
Öt vanádium-oxid ismeretes. homológak. a Vn O2n-1 sorozat (a Magnelli fázis), ahol u = 4-8. Triclinikus rácsból álló fekete kristályok. Fémből van szó. vezetőképesség alacsony hőmérsékleten (a V7O13 kivételével). Antiferromágneses. M. b. a termisztorok félvezető anyagaként használják. A vanádium szintén oxidokat tartalmaz V3 O7 és V6 O13 - fekete kristályokat egy monoklinikus rácskal, amely nem megfelelő módon olvad össze: az első - 660-680 ° C-on a V6O13 képződéséhez. a második - 700-710 ° C-on VO2 képződéssel. A vanádium-oxidok toxikusak. V2 O5 MPC 0,1 mg / m3 (füst), 0,5 mg / m3 (por).
===
App. irodalom a "VANADIUM OXIDES" cikkhez. Pletnev RN Gubanov V.A. Fotiev A.A. NMR a vanádium-oxid-vegyületeknél. M. 1979; Vanádium-oxid: Darstellung, Eigenschaften, Anwendung, V. 1983. J. Ya. Slotvinsky-Sidak.