Az apoptózis 1. részének szabályozása - a rák elleni természet
Az "apoptózis" kifejezés számos definíciója létezik:
- jelenség a programozott sejthalál, kíséretében egy sor jellemző citológiai jellemzői (apoptózis markereinek) és molekuláris folyamatok összefüggő különbségeket egysejtű és többsejtű organizmusok (azaz, változások a felépítése és működése a sejtek jellemző apoptózis).
- a sejtek halálának formája, amely méretének csökkenésével, kondenzációval és kondenzációval, a kromatin töredezésével, a külső és citoplazmatikus membránok duzzadásával nyilvánul meg anélkül, hogy a sejtek felszabadultak a környezetbe.
Az apoptózis lényege abban a tényben rejlik, hogy ez egy programozható sejthalál, azaz. vannak olyan mechanizmusok, amelyek következtében a sejt maga véget vet a létezésének.
A többsejtű szervezetben apoptózis Ohm pusztuló sejtek az embriogenezis folyamán, a T-sejtek a differenciálódás során a csecsemőmirigyben, sejtek vírusokkal fertőzött, abnormális sejtek (ha nincs elegendő intenzitású apoptotikus folyamatokban alakul ki a rák) és még sokan mások. dr.Osnovnoe apotózisra biológiai célt, és a folyamat, hogy hozzon létre az embrionális morfonegeza szervek és szövetek, hogy evolúciósan fix alakzatra és méretű, és majd fenntartani ezek a paraméterek elfogadható tűréshatárok az élet.
A legfontosabb megnyilvánulása ezt a funkciót, apoptózist, és miután a fejlesztését az ember és más emlősök, hogy részt vesz a folyamatban a fiziológiai regeneráció (felújítás) a sejtek a különböző szövetekben és szervekben és karbantartása celluláris homeosztázis. A különböző súlyosságú regenerálódások egész életük során a test szinte minden sejtje alá esnek. Különösen intenzív sejtmegújulás jelentkezik a hámsejtek érintkezésben a külső környezettel, a bőr, gyomor-bélrendszeri, húgy- és pulmonális rendszerek, valamint a vérsejtek az immunrendszer.
Fontos szerepe van az idegen szervek és szövetek elvetésének folyamatában a transzplantáció során.
Az apoptózis egy másik fontos funkciója a sejt belső környezete, beleértve a sejtmagot, annak tartalmával. Igaz, most már bebizonyosodott, hogy apoptózis is előfordulhat a sejtekben hiányzó sejtekben. Ha a sejtben a megengedett határokat meghaladó jogsértések vannak, akkor a sejt önpusztításon megy keresztül. Az apoptózis olyan különböző károsító tényezők hatásával fordul elő, amelyek nekrózist okozhatnak, de kis dózisokban, például magas hőmérséklet, ionizáló sugárzás, tumorellenes szerek hatásával járnak.
Az apoptózis aktívan részt vesz számos fiziológiai és kóros folyamatban. Például, amikor egy hormonfüggő szervi involúció felnőtteknél, különösen, elutasítás az endometrium a menstruációs ciklus alatt, atresia (perforálatlan) tüszők a petefészekben a menopauza, és regresszió (visszafordítani) emlőrák után a szoptatás befejezése.
A szerepe az apoptózis és a kóros és sorvadása hormon-érzékeny szervek, például atrófia a prosztata kasztrálás után és kiürülését a csecsemőmirigy nyiroksejtjeinek amikor glükokortikoid kezelés. Vagy a parenchimális szervek abnormális atrófiája az ürülékcsatornák eltömődését (elzáródása), amely a hasnyálmirigyben és a nyálmirigyekben, a vesékben megfigyelhető. A sejtes halál az atrófia folyamatában a mellékvesekéregben is megfigyelhető glükokortikoidok hatására vagy az endokrin-függő szövetek atrófiájára.
Sok esetben akut vagy krónikus ischaemiás vagy toxikus hatások esetén a sejtek halálát apoptózis okozza. Ez a minta figyelhető meg a stroke, miokardiális infarktus, nem csak, hanem a vesékben, a cukorbetegség, bizonyos formáit nephritis, neurodegeneratív betegségek, például Alzheimer-kór és Parkinson-kór. A máj, a hasnyálmirigy és a vesék mérgező károsodásának patogenezisében fontos az apoptózis aktiválása is.
A sejtek halálának formái, különbségeik
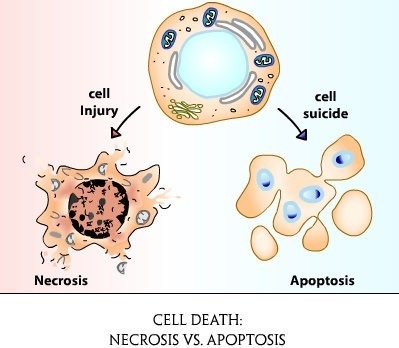
A sejthalálnak két típusa van - nekrózis és apoptózis.
A nekrózis olyan kóros folyamat, amely egy élő szervezetben a helyi szövethalálban megjelenik, ami exo (külső) vagy endogén (belső) károsodásának következménye. A nekrózis a citoplazmatikus fehérjék duzzadásával, denaturálódásával és koagulációjával (sejtjei), a sejtszervezetek és végül az egész sejt duzzadásával nyilvánul meg.
A fő különbség a nekrózis és az apoptózis, és az apoptózis - egy programozott sejthalál és nekrózis - patológiás folyamat indul, válaszul bármely káros hatásait (fertőzés, vegyi anyagoknak való kitettség, expozíció, elégtelen vérellátás, stb) .
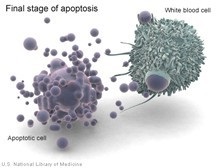
A folyamat során az apoptózis és a sejtek komplex molekuláris kaszkádok, mint amelynek eredményeként van zsugorodása a citoplazma membránon, csökkentve a sejttérfogat folytonossági izzószálak nukleáris DNS kondenzációja kromatin a nukleáris periférián, az ezt követő bomlása a sejtmag részekre, fragmentáció sejtek vezikulumok (hólyagok) intracelluláris tartalmát - apoptotikus testek, amelyeket elfogott a szomszédos sejtek, és a fagociták, mint abban az esetben a nekrózis. A sejtes tartalom felszabadulása nem fordul elő, gyulladás nem fordul elő.
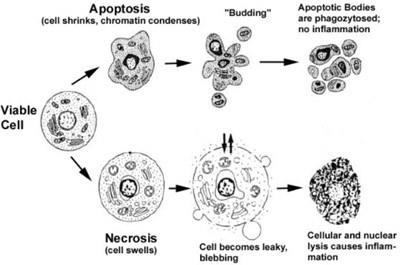
A nekrózis ellenére lizoszómákból lizoszomális enzimek felszabadulnak, amelyek mind a sejt tartalmát, mind a sejtek megduzzadják és felrobbanják. A sejttartalmat az extracelluláris környezetbe dobják, ahol a fagociták felszívódnak, gyulladás alakul ki.
Az apoptózis fiziológiai folyamat, nekrózis-kóros.
A programozható halál egyéb formái is lehetnek, például az autofágia. Az autofágia folyamata az, hogy a szervek kötődnek a lizoszómákhoz, ahol lizoszomális enzimekkel emésztik őket. Ezután a sejtek maradékai elnyelik a makrofágokat.
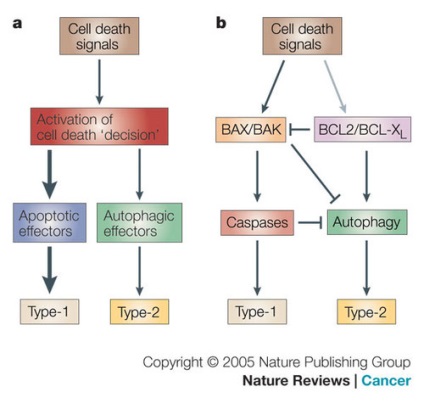
a) - Apoptózis és autofágia egyensúlyának kinetikai modellje. Az egyik halálos hatás aktiválja a programot a sejtben, és a sejt "úgy dönt, hogy meghal". Ha elegendő apoptotikus effektor (az a apoptózisban szerepet játszó molekula), akkor az apoptózis a legtöbb sejtnek a halálos hatásokra adott válasz. Az apoptotikus effektus szuppressziója alternatív útvonalat indít el.
b) - gátló modell. Amikor a letális hatását aktiválja BAX / BAK- függő mitokondriális útvonal vnemembranny (BAX / BAK-függő mitokondriális külső membrán permeabilizálás útvonal) kiváltja az apoptózist. A BAX / BAK, mint a kaszpáz, a BCL2 / BCL-XL aktív inhibitora, amely elősegíti az autofágist. Az aktív apoptózis elnyomja az autofágist.
Apoptózis 3D modellje
Apoptózis mechanizmusa
Az apoptózis mechanizmusa összetett és változatos, komplex molekuláris kaszkádot jelent, amelyet sok és sok laboratórium szerte a világon tanul. Ezeknek a vizsgálatoknak az onkológiai és gerontológiai szempontból való vitathatatlan jelentőségét bizonyítja az onkológiai betegségek kezelésének sikere az apoptózis indukciójában a rákos sejtekben. Tehát mi a mechanizmus. Beszéljünk erről részletesebben.
Az első szakasz egy haláleset
Hol kezdődik ez a komplex folyamat? Mivel a sejt megkapja a "halálmegrendelést", annak halála szükséges a szervezet további életében. Ez történik az extracelluláris tápközegből származó jelek segítségével, amelyeket a sejt érzékelői segítségével érzékel. Néha az apoptózis kialakulásának jelzése lehet a szükséges jel hiánya is.
A jelmolekuláknak a receptor fehérje külső részével történő érintkezésének következtében ez a receptor szerkezeti változásokon megy keresztül. A szerkezeti átrendeződés megragadja a receptor molekula intracelluláris részét is. Lehet, hogy maga is rendelkezik egy bizonyos enzimatikus aktivitással, vagy szoros kapcsolatban áll bizonyos sejtenzimekkel. A receptor molekula aktivitásának változása az enzim aktiválódásához vezet.
Gyakran a kalciumionkoncentráció megváltoztatásának kérdése. valamint a viszonylag kis foszfortartalmú szerves vegyületek is, amelyek a nukleotidok osztályába tartoznak.
Az aktív vegyületek a sejtmembrán egyes lipidjeinek hidrolízisével is előfordulnak. Mindezek következtében a fehérje szabályozó molekuláinak (foszforiláció) foszfátmaradványok kötődését vagy leválasztását eredményezik, amelyek hatással lehetnek a sejt genetikai apparátusára.
A foszforilezés és defoszforiláció (a foszforsavmaradék hasítása), valamint más biokémiai módosítások megváltoztatják ezen szabályozók aktivitását.
A "halálos jelet" észlelő receptorok
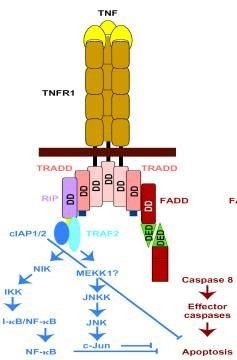
Két szerkezetileg homológ TNF-receptor van ismert. p55 és p75 (TNF-RI és TNF-RII) transzmembrán I-es fehérjékkel kapcsolatos. Ezenkívül a CD95 "halál receptorai" is érintettek. A CD95 receptorok és a TNF-receptorok olyan receptorok növekvő szupercsaládjához tartoznak, amelyek homológiát mutatnak extracelluláris doménekben. A család az idegi növekedési faktor receptorát is tartalmazza. B-sejt antigén CD40. a T-limfociták CD27 aktiválásának markere és néhány emlős és vírus homológ fehérje.
A CD95 és a TNF-Rl további homológ szekvenciát tartalmaz a molekulák intracelluláris részében. Ez a transzdukció citotoxikus (sejtkárosító) jel. A CD95 citoplazmatikus C-terminusa szintén tartalmazza a "mentési tartományt". amelynek eltávolítása fokozza a receptor citotoxikus aktivitását.
TNF-ligandum és a CD95 (CD95-L) transzmembrán fehérjék egy második típusú extracelluláris C-terminális, N-terminális intracelluláris és transzmembrán egyedülálló elemek, hanem ezek működhet egy oldható, „rétegesen” a membrán formáját. És CD95-L, a TNF és kötődnek a megfelelő receptorhoz, mint egy trimer, „térhálósított” 3 receptor molekula, hogy aktiválja azt adásra pro-apoptotikus szignál.
Intenzív kutatás jelátviteli mechanizmusok és apoptózis által indukált anti-CD95 / CD95-L és a TNF, vezettek jelentős előrelépést két irányban - a proteinek azonosítása, amelyek kölcsönhatásba lépnek a CD95 és TNF-R1, és megvilágítja a részvétel a folyamat a második hírvivő ceramid.
A TNF-R1 "haláldoménje" szintén kölcsönhatásba lép a szerin / treonin protein kinázzal, és ezt az enzimet foszforilálja. A 30 C-terminális aminosav-maradék gátolja a receptor kötődését a protein-kinázhoz. Ezeknek az eseményeknek a szerepe a citotoxikus jel továbbításában nem egyértelmű. A közelmúltban írták le a tirozin foszfatázt. FAP-1. kölcsönhatásban áll a CD95, a "mentési domain" 15 C-terminális aminosavával. Az FAP-1 hiperexpressziója elnyomja az apoptózist. által közvetített CD95.
A leírt fehérjék a jelátvitel kezdeti szakaszaiban nyilvánvalóan érintettek. Egy másik adatcsoport azt jelzi, hogy mind a CD95-L, mind a CD95 és TNF elleni antitest aktiválja a szfingomielin átviteli folyamatot.
A CD95 és a TNF-R1 által kiváltott sejthalálat késői stádiumai megegyeznek a klasszikus apoptózissal. E) A sejtvesztés a crmA-val megakadályozható. amely az ICE-szerű proteázok részvételét jelzi. A Bcl-2 elnyomja az apoptózist. a CD95 és a TNF-Rl által indukált, legalábbis néhány sejtvonalon.
A FAS (CD95) részvétele
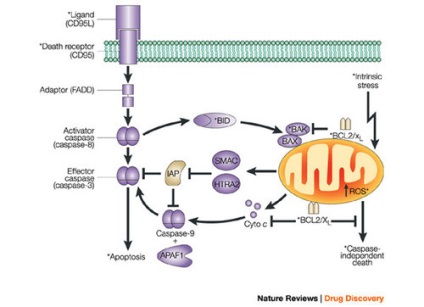
Ez a letális jelátviteli lehet vázlatosan az alábbiak szerint: induktorok - receptor - adapterek -kaspazy első szint -regulators -kaspazy második szint. Így egy receptor, kijelölt Fas, kölcsönhatásban egy megfelelő ligandumot (FasL), egy transzmembrán fehérje egy T-killer aktiválódik és elindul a program sejthalál vírussal fertőzött. Ugyanilyen módon reagáltatva a ligandum FasL felszínén Th1 limfociták vagy antitest a Fas-receptor szerszámtest szükségtelenné válnak a visszanyert B-limfociták, antitest termelők hordozó Fas-receptor. A FasL egy TNF tumor nekrózis faktor nagy családjához tartozó ligandum. Ez a családi homotrimer ligandumok (azaz biológiailag aktív anyagok (fehérjék) álló három azonos domain (részek), kivéve FasL és TNF-a. Tartalmazza TNFb (limfotoxin).
A Fas tagja a TNF receptor családnak. Mint már említettük, mindegyiket transzmembrán fehérjék képviselik, amelyek az induktor ligandumainak trimmerjeivel kölcsönhatásba lépnek extracelluláris helyeken. A receptor és a ligandum interakciója a receptormolekulák klaszterének kialakulásához és az intracelluláris helyek adaptálásához kötődik. Az adapter a receptorral való érintkezés után kölcsönhatásba lép az aktív szekvenciákkal, az inaktivált prekurzorokkal az első kaszpázcsaládhoz (iniciáló kaszpázok).
adapter kölcsönhatás receptorok és effektorok keresztül homofil fehérje-fehérje kölcsönhatási domének kis: DD (haláldomén - a domain a halál), DED (halál-effektor domén - effektor domén a halál), kártya (- aktivációs domént, és kaszpáz toborzó). Mindegyiknek hasonló szerkezete van, hat a-helikális szakaszt tartalmaz. A DD (haláldomén) doménjei részt vesznek a Fas receptor interakciójában a FADD-adapterrel (Fas-associated DD-protein). A DED domainek részt vesznek a FADD adapter és a 8-as és 10-es procaspases kölcsönhatásában.
A legrészletesebbet a procaspase-8 jellemzi, amelyet a Fas receptor a FADD adapteren keresztül vesznek fel. Formázott aggregátumok FasL - Fas - FADD - procaspase - 8. Hasonló kumulatív aggregátumokat neveznek apoptózisnak. apoptotikus saperons. vagy jelző komplexek, amelyek halált okoznak.
A prokaspazynak elhanyagolható proteolitikus aktivitása van, amely az érett kaszpáz aktivitásának 1-2% -a. Mivel a monomer formában léteznek, a procaspázok, amelyek koncentrációja a sejtben elhanyagolható, látens állapotban vannak. Feltételezzük, hogy a procaszpaáz molekulák térbeli konvergenciája az aggregációjuk során aktív kaszpázok kialakulását eredményezi a proteolitikus ön- és kereszt-hasítás (auto- vagy transz-feldolgozás) mechanizmusán keresztül. Ennek eredményeként a szabályozó N-terminális domént (prodomain) elválasztják a procaspáztól (30-50 kDa molekulatömeg), és a molekula maradékát egy nagy (
10 kDa) (3. ábra). Ezután megtörténik a nagy és kis alegységek társulása. Két heterodimer alkot egy tetramert két katalitikus régióval, amelyek egymástól függetlenül hatnak. Így a procaspase-8 aktiválódik, és a citoplazmába kaszpáz-8-nak szabadul fel. A kaszpáz-8 aktiválására más módok is alkalmazhatók - a TNFR1 és DR3 receptorok bevonásával.
Az első kaszpáz aktiválásának szakaszában a sejt élettartama megmaradhat. Vannak olyan szabályozók, amelyek megakadályozzák, vagy éppen ellenkezőleg, fokozzák az első kaszpázák károsító hatását. Ezek közé tartoznak a Bcl-2 proteinek (az apoptózis inhibitorainak, mint: A1, Bcl-2, Bcl-W, Bcl-XL, Brag-1, Mcl-1, és NR13) és Bax (promoterek apoptózist Mivel: Bad, Bak, Bax, Bcl -XS, Bid, Bik, Bim, Hrk, Mtd). Ezek a fehérjék evolúció során konzervált: homológját Bcl-2 kimutatható akár szivacsokat, amelyekben apoptózist szükséges morfogenezis.
A kaszpáz-8 aktiválja a második kaszpázot (effektus kaszpáz): a procaspáz-3 proteolízisével kaszpáz-3 képződik, majd a halálozási program által indított folyamat visszafordíthatatlan.
A kaszpáz-3 képes az önálló további aktiválását (vagy autokatalízisseí avtoprotsessingu) aktiválja számos más kaszpázcsaládba proteázok aktiválja DNS-fragmentáció faktor vezet visszafordíthatatlan bomlanak nukleosomalnye DNS-fragmensek. Így elindulnak apoptózist előidéző proteolitikus enzimek kaszkádja.