Absztrakt fehérje bioszintézis és szabályozása - absztrakt bank, esszé, jelentés, tanfolyam és oklevelek
a kóros aminoacil-adenilátok hidrolízise. Mivel a létezését az aktív helyén ezen enzimek korrekciós mechanizmust, amely biztosítja az azonnali eltávolítását tévesen csatlakozómodulok aminosavmaradék érjük méltóan nagy pontossággal: 1300 kapcsolódó tRNS található aminosavak csak egy hiba.
Az aminosav, amely a tRNS-hez csatlakozik, később nem határozza meg az a-tRNS specifikus tulajdonságait, mivel szerkezete nem ismeri fel sem a riboszómát, sem az mRNS-t. A proteinszintézisben való részvétel csak a tRNS szerkezetétől függ, pontosabban az aminoacil-tRNS antikodon komplementer kölcsönhatásából az mRNS kodonjával.
Az Antikodon a tRNS központi (antikodon) hurokjában található. A tRNS felismerése aa-tRNS szintetázokkal nem mindig fordul elő az antikodon hurkon keresztül. Bizonyos enzimek aktív központja a tRNS térbeli szerkezetének más részeihez illeszkedik.
A riboszómák a ribonukleoprotein képződmények - megkülönböztető "gyárak", amelyekre aminosavak fehérjékké alakulnak. Az eukarióta riboszómák 80S-os ülepedési konstansok, és 40S (kis) és 60S (nagy) alegységből állnak. Minden alegység tartalmaz rRNS-t és fehérjéket. A 40S alegység rNS-t tartalmaz, 18S szedimentációs konstansokkal és körülbelül 30-40 fehérjével. A 60S alegységben háromféle rRNS-t detektáltunk: 5S, 5,8S és 28S, és körülbelül 50 különböző fehérje.
A fehérjék a riboszóma alegységek egy részét képezik, és egy szerkezeti függvényt hajtanak végre, amely biztosítja az aminosavhoz vagy peptidhez kapcsolódó mRNS és tRNS kölcsönhatását.
A 40S és 60S mRNS jelenlétében az alegységeket kombinálva teljes riboszómát állítunk elő, amelynek tömege körülbelül 650-szer nagyobb, mint a hemoglobinmolekula tömege.
A riboszómában 2 központ található a tRNS molekulák összekapcsolására: aminoacil (A) és peptidil (P) központok, amelyek kialakulásában mindkét alegység részt vesz. Az A és P központok együtt tartalmaznak egy 2 kodonnak megfelelő mRNS-régiót. A fordítás során a Center A társítja az aa-tRNS-t, amelynek szerkezetét a központ régiójában található kodon határozza meg. A kodon szerkezetében kódoljuk az aminosav természetét, amely a növekvő polipeptid láncba kerül. A Center P foglalja el a peptidil-tRNS-t, azaz a már szintetizált peptidlánccal társított tRNS.
Az eukariótákban a riboszómákat a 2. típusú "szabad", a sejtek citoplazmájában található és az endoplazmatikus retikulumhoz (ER) társítják. Az ER-hez társuló riboszómák felelősek a vérplazmába bejutni és az ER fehérjék megújulásában való részvételért felelős "kiviteli" fehérjék szintéziséért; a Golgi-készülék membránja, a mitokondrium vagy a lizoszóma.
A mitokondriumok tartalmazzák a saját riboszómakészletüket. A mitokondriális riboszómák kisebbek, mint az eukarióták riboszómái, prokarióta és 55S-os ülepedési konstansuk. Két alegységből is állnak, de különböznek az eukarióta riboszómáktól az RNS és a fehérjék mennyiségével és összetételével.
Fehérje faktorok
A fehérje szintézis minden egyes szakaszában a riboszómában: az iniciálás, megnyúlás és megszüntetés más nem riboszómális fehérje faktorokat tartalmazott. Ezek a fehérjék kötődnek a riboszómához vagy annak alegységeihez a folyamat egyes szakaszaiban, és stabilizálják vagy elősegítik a fehérje-szintetizáló gép működését.
ATP és GTP energiaforrásként
A beépítése egy aminosavat a növekvő polipeptidlánc ketrecben expends kötési energiája 4 2 ATP által katalizált reakcióban az AA-tRNS-szintetáz (ATP aktiválás során az aminosavak hasítunk AMP és pirofoszfát), és a 2 GTP-molekula: egy használjuk a kötődési aa tRNS-t a riboszóma A-centrumában, a második pedig a transzlokációs szakaszban. Ezzel | hozzá kell adni a használatát két más, nagy energiájú kötések molekulák: ATP-t és GTP az iniciációs és terminációs szintézisének a polipeptid lánc.
A polipeptidlánc szintézisének lépései
A fehérjeszintézis egy ciklikus, többlépcsős, illékony folyamat, amelyben a szabad aminosavak egy genetikailag meghatározott szekvenciába polimerizálnak polipeptidek előállítására. fehérjeszintézist rendszer, vagy pontosabban egy műsorszóró rendszer, mely a genetikai információ átírt mRNS szintézisére egy polipeptid lánc egy adott elsődleges szerkezete, magában foglalja a körülbelül 200 típusú makromolekulák - fehérjék és nukleinsavak. Közülük mintegy 100 a makromolekulák aktiválásában részt vevő aminosavak és átadják a riboszómák, több mint 60, a makromolekulák alkotó 70S vagy 80S riboszómák, 10S és körülbelül makromolekulák, közvetlenül részt vesznek a fordítási rendszer. Figyelembe véve a szintézis szempontjából fontos egyéb tényezők természetét, fontoljuk meg részletesebben a fehérjemolekula szintézisének egyes módjait egy mesterséges szintetizáló rendszerben. Először is, az izotópos módszer alkalmazásával kiderült, hogy a fehérjeszintézis az N-terminálison kezdődik, és a C-terminális végével ér véget. a folyamat az irányba halad. NH2®COOH.
A fehérjeszintézis vagy a transzlációs folyamat feltételesen két szakaszba osztható: aminosavak aktiválása és a tényleges fordítási folyamat.
A mátrix fehérje szintézis második fázisa, a tényleges fordítás, amely a riboszómában megy végbe, feltételesen három szakaszba van osztva: iniciálás, megnyúlás és megszüntetés.
Az aminosavak aktiválása
A fehérje szintézishez szükséges feltétel, amely végső soron az aminosavak polimerizációjához kapcsolódik, a nem szabad és úgynevezett aktivált aminosavak rendszerében való jelenléte, amelyeknek saját belső energiaellátásuk van. A szabad aminosavak aktiválását specifikus aminoacil-tRNS szintetáz enzimek segítségével végezzük ATP jelenlétében. Ez a folyamat két szakaszban zajlik:
Mindkét stádiumot ugyanaz az enzim katalizálja. Az első lépésben az aminosav reagáltatjuk ATP és pirofoszfát, és a képződött közbenső terméket, amely egy második lépésben reagáltatunk a megfelelő 3-tRNS ¢ -OH, ezáltal kialakítjuk a aminoacil AMP -tRNK és lemerült. Az amino-acil-tRNS-nek rendelkeznie kell a szükséges energia tartalékkal.
Az aminosav a 3 ¢ -OH-hidroxil-AMP terminálhoz van kötve, amely a CMP két aminosavával együtt a CTC terminális tripletjét képezi, amely minden közlekedési RNS esetében megegyezik.
Fordítási folyamatok
Transzlációs iniciációs egy olyan esemény, amelyben van obrazovanie komplex, amely a Met-tRNKimet, mRNS és riboszóma valahol tRNKimet iniciáló metionin tRNKV Ez a folyamat magában foglalja a legalább 10 iniciációs faktorok, amelyek a továbbiakban a eIF (az angol. Eukarióta iniciációs faktorok) a jelezve a számot és a betűt. Kezdetben a 40S alegységét a riboszóma kötődik iniciációs faktor, hogy megakadályozza, hogy a kötődés a 60S alegység, de stimulálja a szövetség hármas komplex, beleértve a Met-tRNKimet, EBA-2-t és GTP. Ez az összetettebb komplexum az mRNS 5'-végéhez kötődik több elF részvételével. Az egyik iniciációs faktorok (ELF-4F) felfedezi, és csatlakozik a szakasz „sapkát” a mRNS molekula, így nevezték kepsvyazyvayuschego fehérje. Amikor kötött mRNS, 40S alegység, elkezd kicsúszni mentén nem kódoló része a mRNS, amíg, amíg el nem éri a AUG-startkodon kódoló nukleotid szekvenciát. Csúszás 40S alegység mRNS kíséri az ATP hidrolízisével, energiát fordítunk leküzdésében részletekben spirális a nem transzlálódó részét a mRNS-t. Eukarióta mRNS Klek nem-kódoló régiók, különböző hosszúságú, de jellemzően 40-80 nukleotid, bár vannak olyan területek, amelyek hossza több mint 700 nukleotid.
Amikor elérte az elején a kódoló szekvencia az mRNS, 40S alegység leáll, és kötődik egyéb iniciációs faktorok, gyorsuló tapadását 60S alegységét 80S riboszómák és a kialakulása miatt a GTP GDP és szervetlen foszfát. Ebben a formában a A- és P-pont a riboszóma, és az F-központban AUG-mRNS adjoint hozzá Met-tRNKimet.
Az AUG kodon felismerő sejtekben 2 különböző tRNS található. Az iniciáló kodon elismeri a tRNS-t, és a metioninnak a fehérje belső régióiba való bejutását kódoló mRNS-tripleteket egy másik tRNS
Az adagolás befejezése után megindításától mRNS riboszóma elhelyezni, hogy a központ egy P-AUG iniciációs kodont az ahhoz csatolt Met-tRNKimet. és az A-központban - egy triplet, amely kódolja a szintetizált fehérje első aminosavának felvételét. Következő kezdődik a leghosszabb fázisa fehérjeszintézis - nyúlás, amelynek során a riboszóma keresztül AA-tRNS szekvenciálisan „olvas” mRNS kódoló nukleotid triplettek kövesse az iniciációs kodon az 5 „a Z'-végén, a növekvő polipeptidlánc köszönhető, hogy a szekvenciális aminosavak hozzáadása.
A fehérjék egyes aminosavainak bevitele 3 fázisban történik, amelyek során:
• a proteinbe belépő egyes aminosavak aa-tRNS-ja kötődik a riboszóma A-centrumához;
• a peptidet a peptidil-tRNS a P-elhelyezkedő központ csatlakozik egy-NH2-Gruppe aminoacil maradékot AA-tRNS-központban, hogy egy új peptid kötés;
• a peptidil-tRNS egy aminosavval meghosszabbodik, az A-centrumból a P-központba mozog a riboszóma transzlokációjának eredményeképpen.
Az amino-acil-tRNS kötődése az A-centrumban. MRNS kodon található A-központ közelében, a start kodon határozza meg a jellegét aa -tRNKaa ¢ ¢, amely tartalmazni fogja az A-Center. aa ¢ ¢ -tRNKaa kölcsönhatásba lép a riboszóma egy hármas komplex tagjai faktor EF-1 nyúlás, aa -tRNKaa ¢ ¢, és GTP komplex kölcsönhatásba lép a riboszóma hatékonyan, ha a antikodonja aa -tRNKaa ¢ ¢, komplimentaren antiparalel kodon mRNS-t az A-centerben. Rátérve aa -tRNKaa ¢ ¢, riboszóma miatt előfordul, hogy az energia a GTP hidrolízisét a GDP és a szervetlen foszfát
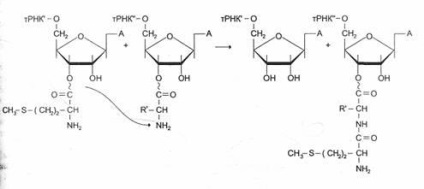
A peptidkötés kialakulása közvetlenül az EF-1 és a GDF komplex eltávolítása után következik be a riboszómából. A folyamat ezen szakaszát a transzpeptidációs reakciónak nevezzük.
A reakció során, a metionin maradékot AA -tRNKaa ¢ ¢, kötődik az a-amino-csoport az első aminosav kapcsolódik egy Trnka ¢, és pacpolozhennoy A-központ peptidkötés képződik először. Megállapították, hogy a riboszóma nagy alegységének peptid-transzferáz aktivitása a 28S rRNS-hez tartozik. Eddig az egész RNS-csoportot fedezték fel, amely enzim tulajdonságokkal rendelkezik. Ezek a katalitikusan aktív RNS nevezzük ribozimok úgy gondoljuk, hogy a ribozimok lehet tekinteni „emlékei” a korai időszakban a forradalom, amikor a fehérjék még nem szerezték, így fontos, mint a későbbi időszakokban.
A transzlokáció a nyúlás harmadik szakasza. Az EF-2 megnyúlási faktor a riboszómához kapcsolódik, és a GTP energia hatására a riboszómát az mRNS mentén egy kodonba mozgatja a 3'-végéig. Ennek eredményeképpen a dipeptidil-tRNS, amely nem változtatja meg pozícióját az mRNS vonatkozásában, az A-centrumból a P-központba mozog. A metioninmentes tRNAa, ¢, elhagyja a riboszómát, és a következő kodon belép az A-centrum területére.
A harmadik szakasz végén a riboszóma megnyúlása a P-centrumban dipeptidil-tRNS-t tartalmaz, és egy triplet, amely egy második aminosavnak a polipeptidláncba való felvételét kódolja, az A-centrumba jut. Megkezdődik a megnyúlási szakasz következő ciklusa, amely alatt a fent leírt események ismét átmennek a riboszómán. Az ilyen ciklusok ismétlése az mRNS szemantikai kodonjai szerint teljesíti a teljes megnyújtási lépést.
A fordítás befejezése akkor következik be, ha az egyik stopkodon: UAG, UAA vagy UGA a riboszóma A-középpontjába esik. A stop kodonokhoz nincs megfelelő tRNS. Ehelyett két fehérje felszabadító tényezőt (angolul, felszabadító / színész) vagy egy végződési faktort csatolnak a riboszómához. Egyikük a peptidil-transzferáz központot használja fel a szintetizált peptid hidrolitikus hasításának katalizálására a tRNS-ből. A másik a GTP hidrolízisének hatására a riboszóma alegységekbe történő disszociációját okozza.
Érdekes, transzlációs faktorok felismerve hatások miatt GTP hidrolízisét, amelyek szupercsaládjának tagjai a G-fehérjék, amely magában foglalja a G-fehérjék jelátviteli hormonok és más biológiailag aktív anyagok és a Ras-fehérjék, amelyek mint a növekedési faktorok. Az összes G-fehérje kötődik és hidrolizálja a GTP-t. Amikor össze vannak kapcsolva, hogy a GTP, az aktív és részt vesznek a megfelelő anyagcsere folyamatok, és amikor az aktív oldalon eredményeként a GTP GDP alakítjuk, ezek a fehérjék inaktívvá válnak konformációt.
Így a transzlációs folyamat mátrix jellege abban nyilvánul meg, hogy a fehérjeszintézis riboszómájának aminoacil-tRNS-szekvenciájának szekvenciáját szigorúan az mRNS határozza meg, azaz a kodonok elrendezésének sorrendje az mRNS lánc mentén egyedileg határozza meg a szintetizált fehérje szerkezetét. A riboszómák az mRNS láncot tripletek formájában vizsgálják, és egymást követően kiválasztják a "szükséges" aa-tRNS-eket a környezetből, és a dezacilált tRNS-ket felszabadítják a nyúlás során.
Kis és nagy riboszomális alegység: a fordítási folyamatot különböző funkciói: a kis alegység mRNS tulajdonít dekódolja az információt használja tRNS transzlokáció mechanizmusa és a nagy subedanitsa felelős a peptid-kötések.
poliriboszómáikat
A fehérjeszintézis során a riboszóma az mRNS 5'-végéhez csatlakozik, és a 3'-végirányban mozog. Ebben az esetben felszabadul az mRNS 5'-vége, és csatlakozhat egy új riboszóma, amelyre egy másik polipeptidlánc indul. Rendszerint sok riboszóma egyidejűleg részt vesz a fehérjeszintézisben ugyanazon mRNS-ben, és polyribosome-nak vagy polysomának nevezik.
Mindegyik riboszóma körülbelül 80 nukleotid hosszúságú mRNS-helyet foglal el, így a riboszómák körülbelül 100 nukleotidos intervallumokban helyezkednek el az mRNS-en. Minél hosszabb a szintetizált fehérje polipeptidlánca, annál több riboszómával képes egyidejűleg szintetizálni ezt a fehérjét, ezáltal jelentősen növelve a mátrixfelhasználás hatékonyságát.
Minden egyes riboszóma képes körülbelül 100 peptidkötés / perc képződésének katalizálására. A polibiboszómák a sejtek citoplazmájában lebegő részecskékként létezhetnek, vagy az ER-hez társulhatnak. Az ingyenes citoplazmatikus poliborozom részecskék felelősek az intracelluláris funkciókat ellátó fehérjék szintéziséért. Az elektronmikroszkóp alatt ER-hez társuló polibiboszómák "durva" felületűek. A "durvább" ER-vel szintetizált fehérjéket a membránon keresztül kell szállítani, hogy elérjék a végleges lokalizáció helyét. Ezek jellemzik a vezető vagy jel, a 15-30 aminosav szekvencia jelenlétét, amely számos aminosavat tartalmaz hidrofób gyökökkel, és biztosítja a protein átjutását a membránok lipid kettős rétegén keresztül. Ezeknek a fehérjéknek a további szállítására a Golgi-készüléket a szekréciós granulákba csomagolják.
Szintetizált fehérjék szállítása membránokon keresztül.
Mitokondriális fehérjék szintézise
A magasabb organizmusok sejtjeinek mitokondriuma a celluláris DNS legfeljebb 2% -át tartalmazza, amely különbözik a mag DNS-jétől. A mitokondriumok tartalmazzák az egész készüléket, beleértve a riboszómákat, a tRNS-t és a mRNS-t, amelyek bizonyos fehérjék szintéziséhez szükségesek. A szintetizált fehérjék mitokondriumokban elsősorban oldhatatlan fehérjék részt szervezésében Ezek szerkezete organellumok, míg a szintézise oldható forrása mitokondriális fehérjék citoplazmatikus riboszómák ahol azokat majd szállítani a mitokondriumba. A mitokondriumok riboszómái kisebbek, mint a citoplazmában található 80S riboszómák. Érdekes, mint a kezdeményező aminosav fehérjeszintézis eukarióta mitokondriumokban lehet vonni N-formil-metionin, nem szabad metionin, mint a citoplazmában. Ez a körülmény arra utal, hogy a mitokondriális fehérje szintézise mechanizmusa révén nyilvánvalóan közel áll a fehérjeszintézishez a prokariótákban.
A polipeptidlánc poszt-transzlációs módosításai
A polipeptidláncok strukturális módosításokat hajthatnak végre, vagy még mindig kötődnek a riboszómákhoz vagy a szintézis befejezése után. Ezeket a konformációs és szerkezeti változásokat a polipeptidláncokban poszttranszlációs változásoknak nevezzük. Ezek közé tartozik a polipeptidlánc egy részének eltávolítása, egy vagy több kis molekulatömegű ligandum kovalens kapcsolódása, a natív konformáció megszerzése a fehérjével.
Az ER-ben számos módosítás történik. Itt polipeptidláncok összehajtása megtörténik, és a fehérjék egy egyedülálló tercier vagy kvaterner szerkezete képződik. A molekulák natív konformációjának fenntartása érdekében nagy jelentőséggel bír a diszulfidkötések megfelelő kialakulása.
Részleges proteolízis
Számos, a sejtekből szekretált fehérjét először szintetizálnak olyan prekurzor molekulák formájában, amelyek funkcionálisan inaktívak. A polipeptidláncnak egy adott endoproteáz enzimmel való eltávolítása aktív molekulák képződéséhez vezet. Néhány fehérje prekurzort az ER-ben vagy a készülékben hasítanak; A Golgi. mások a szekréció után. Így, inaktív prekurzorok a szekretált enzimek - zimogének - képezik az aktív enzim hasítása után az egyes részeinek a molekula: hasnyálmirigy zimogén tripszinogén átalakul aktív tripszin után szekréció