Hidrogén, egyensúlyi nyomás - vegyész útmutató 21
Hidrogénezés és destruktív hidrogénezéssel - egy másodrendű reakciót nagy hidrogén egyensúlyi nyomások kimenetek felé tolódott a kialakulását a telített vegyületek és a hidrogénezés jön majdnem a végén. [C.141]
A reakció sebessége a katalizátor jelenlétében k [CO2] [a], és - állandó jellemzője a katalizátor és a hőmérséklettől függ, és [a] - koncentrációja a katalizátor adalék. A reakció így. első rendelés. Egy ion vagy molekula jelenlétében, amely a hidrogénionnal reagál. (X, 2), a katalizált hidratálás az egyensúly eléréséig folytatódik. Így a karbonátionok jelenlétében (és az oldat feleslegénél jelentéktelen egyensúlyi COa nyomás mellett) a reakciót követően [244]

Fluor-hidrogén-sav (hidrogén-fluorid), hidrogén-fluorid vízben. Elavult. neve - a hidrogén-fluorid. A HF-H O rendszerben 3 kapcsolat lehet. NR NR (LEO P „), Hio-2HF (NRT + HF) és Hjo-4HF, op to-ryh ill. -36, -78 (bomlik). -100 ° C t.-pl. evtektich Hjo elegyet -.... H2O -72 C-on HF azeotróp elegyet (38,2% HF tömeg) fp 114,5 ° C-on az összes készítmény, nem-azeotropos, FK nem kongruens bepároljuk egyensúlyi gőznyomás. HF és N O ur fent leírt FK-niem IGP (Ha) = a - BIT, együttható értékeket, lásd a táblázatot [c.202] ...
A hidrokrakkolási folyamat kinetikája. Megoszlási és izomerizációs reakciók hidrokrakkolási folyamatokban. tipikus elsőrendű reakciók. A szénhidrogének bomlását gátolja a hasítási termékek kialakulása és az adszorpciós körülmények megváltozása [271, 272, 273]. Hidrogénezés és destruktív hidrogénezés, másodrendű reakciók nagy hidrogénnyomás alatt, az egyensúly a telített vegyületek képződéséhez való elmozdulást eredményezi, és a hidrogénezés szinte a végéig megy végbe. A hidrogén szükséges parciális nyomásának fenntartásához jelentős felesleg szükséges, hogy a bimolekuláris hidrogénezési lépéseket pszeudomonomolekuiáris reakciók egyenleteivel írják le. Így. A hidrokrakkolás során előforduló reakciók többségének elsőrendűnek kell lennie. ami igaz a hasadásra és az izomerizációra, és úgy tűnik, hogy nyilvánvaló a hidrogénezéshez [274]. [C.245]
Hasonlóképpen a 3 mól hidrogén p2 nyomástól az egyensúlyi nyomásig történő átalakításán végzett munka a [c.196] egyenletben fejeződik ki,
Egy vizuális értékelést, hogy milyen kicsi ez az érték Kp önkényesen, hogy a metán és a hidrogén egyensúlyi nyomás megegyezik [c.146]
Következésképpen, a hidrogén mennyisége adszorbeált (vagy a fokú felületi lefedettség), és a logaritmusát az egyensúlyi hidrogén nyomás lineáris az összefüggés [c.43]
Számítsa ki a hidrogén egyensúlyi nyomását anélkül, hogy figyelembe veszi a titán oldhatóságát. [C.229]
A mérésére adszorpciós izotermák a tiszta gázok az adszorber a hengerbe a puffer tároló szivattyúzzuk egy nyomógáz - (1-2) -10 Pa (100-200 kg / cm). Az adszorbens nyomása után, a standard manométerrel regisztrálva. az adszorbensből származó gáz lassan kiürül, a kimenő gáz sebességét a reométer mentén 300 cm / perc értéken állandóan tartják. A felszabaduló gáz pontos térfogatát a gázmérő határozza meg. Bizonyos időközönként a felszabadított gáz mennyiségét és a rendszeren belüli egyensúlyi nyomást mérik. A gáz többi részét a hidrogén atmoszferikus nyomáson felszívja az adszorbensből. a kimenő keverék összetételét a gázelemző határozza meg a hővezetőképesség és az adszorbát mennyisége tekintetében. a felszabadulást követően kiszámítva kiszámítjuk a kimeneti graft integrálását. [C.167]
Ha az inert gáz forrás tartalmaz 1% oxigént és 2,1% hidrogén, az egyensúlyi nyomás oxigén 500 ° C-on egyenlő 7-10 „2b. A hidrogén (anélkül inert szennyeződések), egyensúlyi oxigén parciális nyomása kisebb,. 500 ° C-on és kezdeti oxigéntartalma 1%, 7-10 "32". A számítási eredmények azt mutatják, hogy legfeljebb 500 ° C-on keverékét sztöchiometrikus összetételű (N3 + ACP) és legfeljebb 1000 ° C-kis feleslegben hidrogén a reakció hidrogén oxigénnel kölcsönhatás is figyelembe kell venni, mint egy visszafordíthatatlan. [C.330]
13. példa T = 693 K, a hidrogént és a jódot egy edénybe helyezzük. Az edény zárt reakció a hidrogén és a jód között V = onst. Az egyensúly megállapítása után. A reagensek egyensúlyi nyomását meghatározzuk és / vagy kapjuk meg. = 0,007-10 n m = 0,300-105 nlm. Pf. = 0,32 -10 hJm. Számítsd ki a H3 és h (n / m) kezdeti nyomást. [C.238]
Mindegyik potenciál a 2H20 / H2 konjugátumrendszerben (c.50) lévő hidrogén fiktív egyensúlyi nyomásának tulajdonítható.
Ezért az A gáz A egyensúlyi nyomása az oldat felett ugyanazon fordulatszámnál alacsonyabb, mint az oldat átalakulásának hiányában. Az oldhatóság ennek megfelelően növekszik. Ez megmagyarázza a gázok vízben való rendkívül magas oldhatóságát, mint például a hidrogén-klorid és az ammónia. [C.38]

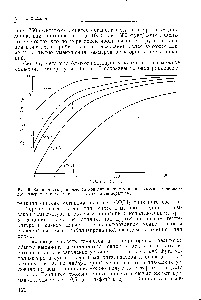
Az egyes exoterm hidridek képződésének folyamata a nyomás és a hőmérséklet függvényében egyensúlyi nyomás izotermékeivel ábrázolható. Az 1. ábrán. 47 predszt. Egyensúlyi nyomás izotermák számos hidridhez [71, 81, 81], amiből az alábbiak. hogy ha a hidrogén egyensúlyi nyomása megemelkedik, az ötvözet koncentrációja növekszik. Amikor elérik az oldhatósági határértéket, új szakasz léphet fel. amelynek létezése a Gibbs fázisainak törvénye szerint jellemző a nyomástartó réteg kialakulása. Az egész ötvözetnek egy primer hidridre (I fázisra) történő átalakítása megfelel a fázis sztöchiometriai és a nyomás intenzív növekedésének. Ha az ötvözet egy második fázist (-fázis), például PeT1-et (47. ábra, b) képezhet, akkor egy másik nyomástábla jelenik meg. Ezután a nyomás ismét meredeken emelkedik. [C.81]