Számos szabványos elektródpotenciál (feszültség)
Nikolay Nikolaevics Beketov (1827-1911)
1. Minél kisebb a fém elektródpotenciálja, annál kémiailag aktívabb, könnyebb oxidálni és nehezebb visszanyerni az ionjaiból. Az aktív fémek csak Na-formában léteznek, a K. vegyületek természetben megtalálhatók mind a vegyületek, mind a Cu, Ag, Hg szabad állapotában; Au, Pt - csak szabad állapotban;
2. Fémek, amelyek negatív elektróda potenciállal rendelkeznek, mint a magnézium, hidrogént kiszorítva a vízből;
3. Hidrogénsavoldatokból származó hidrogéneket kiszorító hidrogént tartalmazó fémek (amelyek anionjai nem mutatnak oxidatív tulajdonságokat);
4. Minden nem fémes fémvessző, amely az elektrodepotenciálok pozitívabb értékeit tartalmazza sóik oldatából;
5. Minél több fém különbözik az elektródpotenciál értékeinél, annál nagyobb az emf érték. egy galváncellát építenek ki.
Az elektródpotenciál (E) függését a fém természetétől, az ionok aktivitásától az oldatban és a hőmérsékletben a Nernst-egyenlet
ahol E o Me a fém standard elektródpotenciálja, és Me n + a fémionok aktivitása az oldatban. 25 ° C-os standard hõmérsékleten hígított oldatok esetén az a) aktivitás (c) koncentrációt helyettesítve a természetes logaritmus decimális, és az R. T és F értékek helyettesítve
Például a sója oldatába helyezett cinkelektród esetében a hidratált Zn 2+ × mH 2 O ionok koncentrációját Zn 2+ -ként rövidítjük. majd
Ha [Zn 2+] = 1 mol / dm 3. akkor EZn = E o Zn.
Galvanikus elemek, elektromotoros erőik
A só oldatába merített két fém, amelyet egy vezető vezetett össze, galvánsejtet képez. Az első galvanikus sejtet Alexander Volt 1800-ban kitalálták. Az elem rézből és cink lemezekből állt, kénsavas oldattal nedvesített ruhával. Nagyszámú lemez egymást követő összekapcsolásával a Volta elem jelentős elektromotoros erővel (emf) rendelkezik.
A galváncellában lévő elektromos áram előfordulása a fémek elektródpotenciáljának különbsége, és az elektródákon végzett kémiai transzformációk kíséri. Vizsgáljuk meg egy galván sejt működését egy réz-cink elem (J. Daniel - BS Jacobi) példáján.
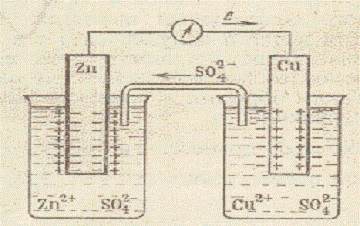
A Daniel-Jacobi réz-cink-galvanikus cellájának rendszere
Boris Semenovich Jacobi (Moritz Herman) (1801-1874)
Cink-oxidáció (cink-feloldódás) Zn o-2e = Zn 2+ történik a cinkelektródon, cink-szulfát (c = 1 mol / dm3) oldatába merítjük. Az elektronok belépnek a külső áramkörbe. Zn az elektronforrás. Az elektronforrás negatív elektróda anódnak számít. A rézelektródon rézszulfát (c = 1 mól / dm3) oldatába merítve fémionok csökken. A rézatomok a Cu 2+ + 2e = Cu o elektródon helyezkednek el. A rézelektród pozitív. Ő a katód. Ugyanakkor az SO4 2- ionok egy része a sóhidakon keresztül átjut egy edénybe ZnS04 oldattal. Az anódon és a katódon előforduló folyamatok egyenletének hozzáadásával megkapjuk a teljes egyenletet
vagy molekuláris formában
Ez a szokásos oxidációs redukciós reakció a fém-oldat felületén. A galvánsejtek elektromos energiáját kémiai reakció útján nyerik. A vizsgált galvanikus cellát rövid elektrokémiai rendszer formájában lehet leírni
A sejt működéséhez szükséges feltétel a potenciálkülönbség, amelyet egy galváncellának (emf) elektromotoros erőnek neveznek. Emf Minden működő galváncellás pozitív. Az emf. a galvánsejtet egy pozitív potenciál értékéből kell venni, hogy a pozitív potenciálnál kisebb értéket vegyen fel. Tehát az emf. (t = 25 ° C, c = 1 mol / dm 3. P = 1 atm) egyenlő a réz (katód) és a cink (anód) szabványos elektródpotenciáljai közötti különbséggel,
Cinkhez kapcsolva a Cu 2+ ion csökken.
A szükséges elektródkülönbség-potenciálok azonos koncentrációjú oldatok és azonos elektródok alkalmazásával hozhatók létre. Az ilyen galvánsejtet koncentrációs sejtnek nevezik. és a megoldás koncentrációjának kiegyenlítésével dolgozik. Egy példa egy elem, amely két hidrogénelektródából áll
Ha p = 101 kPa, s <с``, то его э.д.с. при 25 о С определяется уравнением
C '= 1 mol-ion / dm3 emf elemet a hidrogénionok koncentrációja határozza meg a második oldatban, azaz E = 0,059lgc `` = -0,059 pH.
A hidrogénionok koncentrációjának és ennek következtében a táptalaj pH-értékének meghatározása az emf. A megfelelő galvanikus sejtet potenciometriának nevezik.