Kutatások immunhisztokémiai módszerei, szerzője seleznev a
Az immunhisztokémiai módszer egyik fontos lépcsője az "antigén-antitest" reakció eredményeinek vizualizálása. Az antitesthez kötődő antitestek azonosítása, az antitestek Fc-fragmensével kapcsolatos különféle címkék alkalmazásával. Ezek a címkék a következők lehetnek:
Azonban a fluoreszkáló címkéknek vannak hátrányai:
Ezért további módszereket fejlesztettek ki stabil foltok előállítására, így a készítményeket hagyományos fénymikroszkóppal meg lehet vizsgálni és hosszú ideig tárolni.
A hosszú élettartamú gyógyszerek előállításához a legegyszerűbb címke a fémek, például a kolloid arany. Az "antigén-antitest" reakció eredményeként sötét szín található az antitestek felhalmozódásának helyén egy fénymikroszkópban. Hosszú ideig, fém jelölt antitestek ritkán használják, mert az alacsony érzékenységű, de 1989-ben godu érzékenységét nőtt 100-szor módszerével amplifikációs ezüst és a polarizált fénymikroszkópos [7]. Ritka esetekben a nehézfémekkel jelzett antitesteket a későbbi elektronmikroszkópos vizsgálathoz használják.
Rádióizotópokat is nagyon ritkán használnak a személyzetnek való kitettség magas kockázata miatt. A radioaktívan jelzett antitesteket jelenleg csak az élő sejtkultúrák kutatására használják. A szövettenyészet radioaktív címkével ellátott antitestekkel végzett feldolgozása után a szövetekben keresett antigén mennyiségét meg lehet ítélni a sugárzás mértékével.
A legelterjedtebb enzimcímkék [4]. Az antitesthez konjugált enzim egyik molekulája képes nagy mennyiségű szubsztrátmolekulák "kezelésére", a kapott oldhatatlan festék az antitesthez rögzített antitest köré halmozódik fel.
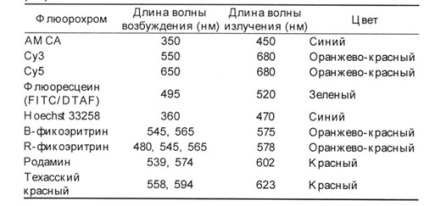
1. táblázat A leggyakrabban használt fluorokrómok jellemzői.
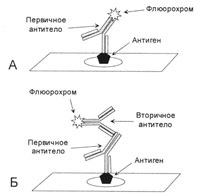
1. ábra: Közvetlen és közvetett vizualizációs módszer
A - az antigén elleni primer antitest tartalmaz egy címkét, például fluorokrómot. B - az antigénnel szembeni elsődleges antitest nem tartalmaz címkét, az elsődleges ellenanyaggal végzett inkubálás után szekunder antitestet adnak hozzá, amely az elsődleges antitesttel kombinálódik. A címke a másodlagos antitesten van.
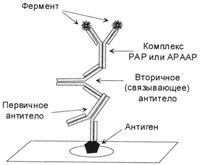
2. ábra A PAP módszer által létrehozott végső komplex.
Az elsődleges ellenanyagot és antiperoxidáz antitestet a PAP komplexben ugyanabból a fajból származó állatokból kell beszerezni.
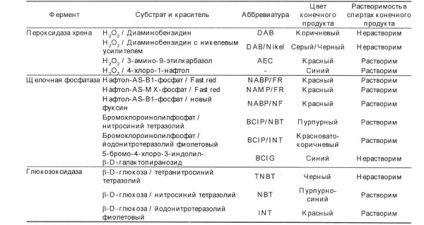
A legelterjedtebben enzimcímként a torma peroxidáz volt, amelyet először Nakane és Pierce, alkalikus foszfatáz és glükóz-oxidáz használt. Mindegyik enzim esetében számos szubsztrát létezik, amelyek az enzim hatása alatt különböző színű, oldhatatlan színezékeket alkotnak. Az enzimek és szubsztrátok lehetséges kombinációit a 2. táblázatban foglaljuk össze.
Nem szabad elfelejteni, hogy a peroxidáz és alkalikus foszfatáz létezik a szövetek a test, így néha a hamis pozitív eredményt [2,3]. A peroxidáz található nagy mennyiségben a neutrofil és eozinofil, ezért festésére vérkenetet, csontvelő és szelet immunrendszer szervei Ezen enzim használata nem ajánlott. Más szövetek festése során egy kis peroxidázaktivitást blokkolnak a hidrogén-peroxid hozzáadásával, mielőtt primer antitestekkel inkubálnák. Az alkalikus foszfatáz számos szövetben megtalálható, így az inkubálás során a szubsztrátumra, azt a hozzá levamizol, de emlékeznünk kell arra, hogy a bél alkalikus foszfatáz, és a méhlepény nem gátolja levamizol, így ezek a szövetek jobban használni más enzimek. A glükóz-oxidáz korlátozás nélkül alkalmazható bármilyen szövet festése során, mert az emlősök szövetében nincs ilyen enzim.
Az enzimcímkék felfedezése óriási előrelépés volt az immunhisztokémiai technológiák fejlesztésében, de az összes problémát nem sikerült megoldani. Az antigének vizsgálata, amelyek kis mennyiségekben vannak jelen a sejtekben (például a sejtfelszínen lévő hormonok receptorai, ioncsatornák), ezeknek a rendszereknek az érzékenysége nyilvánvalóan nem megfelelő.
A vizualizációs rendszerek fejlesztésének következő lépcsője a peroxidázzal és az alkalikus foszfatázzal (PAP és APAAP komplexek) szembeni antitestekkel rendelkező rendszerekké vált. Az eljárás sorrendje a következő. 1. lépés: Elsődleges antitesteket alkalmaznak; 2. lépés: primer (kötő antitest) elleni másodlagos antitesteket alkalmaznak, a másodlagos antitestek egyikének antigénkötő régiói kötődnek az elsődleges antitesthez, a második pedig szabad; 3. lépés: Az azonos fajú állatból származó peroxidáz vagy lúgos foszfatáz elleni antitesteket, amelyekből primer antitesteket állítanak elő, amelyeknek antigénkötő helyeit a megfelelő enzim foglalja el. Ezek az antitestek kötődnek a másodlagos (kötődő) antitestek második antigénkötő helyéhez. Így kialakul egy olyan komplex, ahol az enzim két molekulája már kötődik egy antigénhez (2. ábra), ami növeli a módszer érzékenységét egy 2-es faktorral.
Valódi áttörést jelentett 1979-ben a biotin-avidin komplex alkalmazásával történő közvetett immunfestés módszerének kifejlesztése [5,6].
2. táblázat: Immunhisztokémiai módszerek és azok megfelelő szubsztrátjaiban használt enzimek.
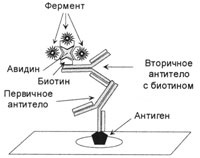
3. ábra. A végső komplex az ABC módszerrel
A komplexum három szakaszból áll. Az első lépésben a jelöletlen primer test csatlakozik egy antigén, egy második lépésben a másodlagos antitestek biotinnal jelzett vannak csatlakoztatva az elsődleges, azt hozzáadjuk a harmadik komplex avidin-biotin-enzim, amely kapcsolódik biotin másodlagos antitesttel.
A biotin egy H-vitamin, kémiai képletét az alábbiakban adjuk meg:
Biotin - olyan vegyület, amely ellenáll a magas hőmérsékletnek, savas és lúgos környezetnek, jól oldódik vízben és alkoholban. Számos addíciós reakcióban (karboxilezés) koenzim. A biotin könnyen köthet stabil kapcsolatot különböző fehérjékkel, köztük enzimekkel és immunglobulinokkal. Számos biotin szereplő fehérjék madárinfluenza tojás, ahol avidinnel glikoprotein, amelynek molekulatömege 68 kDa. Az avidin rendkívül stabil komplexet képez biotinnal (KA = 1015 mol-1). Egy ilyen komplex elpusztítása csak hőmérséklet-feldolgozással lehetséges, tk. Az avidint fűtéssel pusztítják el. Ezenkívül az avidinnek 4 kötőhelye van, amelyhez biotin vagy fehérjék köthetők. Így a biotin-avidin komplex az antitestek és enzimek közötti hídként használható. Ehhez egy biotinhoz és avidinhez kötött enzimből álló komplexet állítanak elő. A központ egy komplexet képez a három-avidin keresztül kapcsolódó biotin kötődését egy enzimmel vagy fluorokróm, míg a negyedik szabadon marad (3. ábra). A biotinhoz kötött másodlagos antitestekkel végzett inkubálás után az avidin-biotin-enzim komplexet adjuk hozzá. Így az antigén egy molekulájával az enzim három molekulája kötődik. Ezt a módszert az ABC nevű-módszerrel (rövidítése Avidin és biotinilezett torma peroxidáz makro-molekuláris komplex). Sajnos, ez a módszer hátránya, mivel a avidin kötődik az endogén biotin, amely egy nagy mennyiség a máj és a vesék, és azt is lehet csatlakoztatni a lektinek és töltött csoportok szövetekben, például az avidin a töltés, ez izoelekticheskaya hazugság a pH = 10,0 tartományban.
Továbbfejlesztése ennek a technológiának kapott megváltoztatása után az avidin streptavidin - fehérje, amelynek molekulatömege körülbelül 60 kD, amely nyert mikroorganizmusok Streptomyces avidinii (SABC-módszer). Streptavidin ugyanolyan képes megkötni biotin, avidin és hasonlók, ezzel szemben nincs töltést hoz létre semleges pH nem kötődik az endogén enzimek és sokkal kevesebb az endogén biotin. Cseréje avidin streptavidin hagyjuk drasztikus csökkentése térfestődés és növeli az érzékenységet a módszer mintegy 8-szor.
3. táblázat: A legismertebb cégek antigénjeinek vizualizációs rendszerei