A vezetõrendszer anatómiája és elektrofiziológiája - a ritmuszavarok diagnosztizálása és kezelése
Oldal 2/32
1. FEJEZET
A SZERELÉSI RENDSZER ANATOMIA ÉS A SZÍV ELECTROPHYSIOLÓGIA
A szívvezetési rendszer anatómiája. Szív vezetési rendszer tartalmaz SU, internodal írásokat, AV-csomó, a His-kötegen és annak ága, a Purkinje-rost és a szívizomban a kamrák (ábra. 1). SU található, a vena cava superior és a jobb pitvar vegyület, annak feje közelebb fekszik a epicardium, a farok található subendocardialis régióiban a felső része a jobb pitvarba.
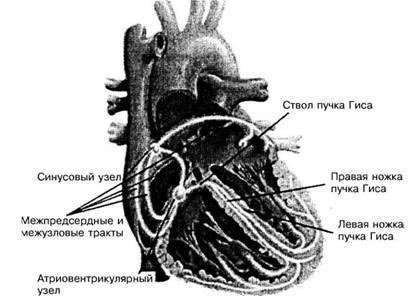
Ábra. 1. A szív irányító rendszere
A CS-ben négyféle típusú sejt található: N-sejtek, P-sejtek (halvány-halvány), amelyek pacemakeraktivitással rendelkeznek; olyan intermedier T-sejtek, amelyek impulzust vezetnek a jobb pitvar szívizomához; a kontraktilis szívizom tipikus sejtjei, világos határok nélkül átjutnak a csomópont szélein és átjutnak T-sejtekbe.
A CS-t az "SS artériákkal" szállítják, az esetek 61% -ában a jobb koszorúér-artéria marad, 39% -a balról.
Csomópontok (intracirkulációs utak). Az első, a középső és a hátsó pályák megkülönböztethetők. Első pálya két ága van, melyek közül az egyik van vezetve a bal pitvarba (Bachman köteg), a másik megy a tetején egy vegyület AB hátoldalán a sövényen. A középső út (egy Wenkebach köteg) a CS-ból az AV-csatlakozásig halad át az interatrialis septum hátsó részén. A leghosszabb - vissza sinoatrioventrikulyarny path (Toreli fény) indul a SS, halad át a sinus coronarius és összeolvad az alján a AV kapcsolatot. Az átrium vezető rendszere szerint az impulzus kétszer olyan gyors, mint az izomszövetben.
Az AV kötés az alsó részen található, az interatrialis septum jobb oldalán helyezkedik el, a belső tricuspidalis szeleplap felhelyezési helye felett. A morfológia helyzetéből az "AV csomópont" fogalma a legalkalmasabb, az elektrofiziológia és a klinika pozíciójából - az "AV kapcsolat" kifejezés elfogadhatóbb. Szélessége 4 mm, hosszúsága - 6 mm, vastagsága - 1,5 mm. Pacemaker sejteket és impulzusokat hordozó sejteket tartalmaz. Az impulzusok ugyanolyan sebességgel hajthatók végre mind a kamrák irányában (anterográd), mind pedig fordítva (retrográd). Az AV vegyület funkcionális tulajdonságaitól függően 4 rész van: az átmeneti sejtek zónája; kompakt AV csomópont; Az AV csomópont behatoló része; az AV csomópont elágazó része. Az első két rész az AV kötés pitvari része, a másik kettő kamrai. A pitvar az interatrialis septum alján helyezkedik el, elsősorban a központi szálas gyűrű jobb oldalán.
Kompakt AV csomó belül található a háromszög a Koch, anatómiailag jól elkülöníthető régió, amelynek határai teszik ki ín Todaro, tebeziev szelep a sinus coronarius és a tricuspidalis annulus (ábra. 2).
Egy kompakt csomópontban három fő sejtcsoportot különböztetünk meg: az AN-sejtek a periférián helyezkednek el, az N-sejtek középpontjában állnak, az NH-sejtek a köteg behatoló részével határosak. Funkcionálisan a legfontosabb terület az AN, ahol az impulzus fiziológiai késése történik. A pacemaker-sejtek a legaktívabbak az NH zónában. Az AV-kapcsolat fő funkciója a szívizom szupraventrikuláris struktúráiban előforduló szuper-gyakori impulzusok védelme.
Az AV kötés vérellátását az AV csomó "artériája" biztosítja, amely az esetek 83% -ában a jobb koszorúér artériából, balról 7% -ot és mindkettőtől 10% -ig terjed.
Az ő köteg, ágai, Purkinje rostjai. Bundle Ő egy kiterjesztése az AV kapcsolatot, de az átmenet a kompakt egység ventriculonector így észrevehetetlen, hogy morfológiailag lehetetlen meghatározni a helyét a közvetlen átmenet egyik formáció a másikra. A köteg hossza 15-20 mm, szélessége 1-4 mm. A behatoló része (10 mm) átjut az MZV-ben lévő középső szálas testen (rostos szövetben), mind az atrioventricularis
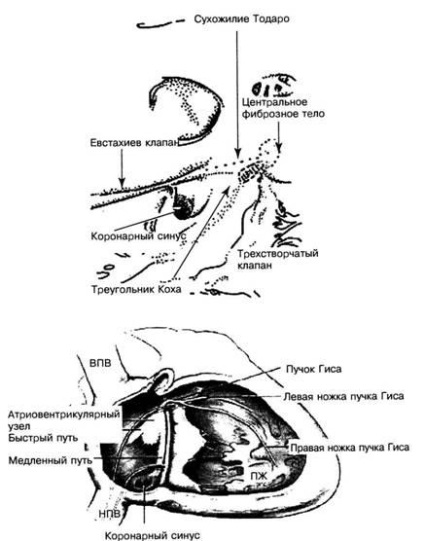
Ábra. 2. A Koch háromszög szerkezete
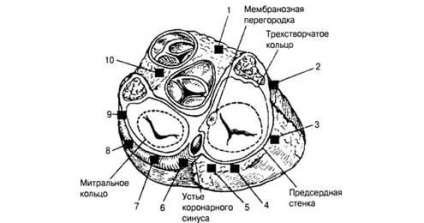
Ábra. 3. További vezetési módok lokalizálása. A szív keresztmetszete a szálas gyűrű szintjén: 7 - jobb oldali septális; 2 - jobb első; 3 - jobboldali; 4 - jobb hátsó; 5 - jobb paraceptális; 6 - bal hátsó paresisális; 7 - bal hátul; 8 - bal oldali; 9 - bal első; 10 - bal első paresisális
gyűrűket. Ezután a köteg az IVF izomzatának felső széle mentén halad, és elágazó szegmenst alkot a jobb és bal lábak formájában. A határait a elágazási rész ventriculonector vannak tricuspidalis annulus (a hátsó) és egy ürítő vége a bal láb szárblokk (elöl). Az ő kötegének jobb oldala előre és lefelé irányul az IVF jobb felének belső rétegeihez és a jobb kamrához. A bal lábát pedig a folytatása a köteg eléri subendocardialis a bal fele a interventricular septum és a bal kamra és van osztva két vagy három fő ága van: az első, amely illeszkedik az alapja az elülső papillaris izom; Vissza - közeledik a hátsó papilláris izomhoz. A 60% -ában van kialakítva egy harmadik ága a bal szárblokk lábak - sredneseptalnaya - a bal lábát része felosztása hely a fő ága, hogy a közepén az interventrikuláris septum. A végső kapcsolatot a vezetési rendszer - a Purkinje rostokat, amelyek vannak elhelyezve mindkét kamrában subendocardialis rétegeket, és közvetlenül kötődik a miokardiális kontraktilis sejtek.
További vezetési módok (3. ábra). Pulse a SU lehet elosztani nem csak az AV csatlakozás, hanem a további anatómiailag járnak el: terjedési sebesség a DPP jelentősen magasabb, mint az AV-csatlakozó, amely megteremti előfeltételei korai aktiválása a zónákban, ahol a végén kiterjesztése útját. A szív kamrai korábbi gerjesztését gerjesztésnek nevezték.
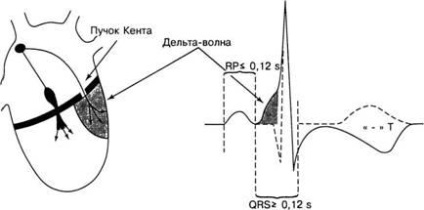
Ábra. 4. A WPW jelenségek elektrokardiográfiás jeleinek kialakulása: rövidített PQ intervallum; kiterjesztett QRS komplex és delta hullám; az ST szegmens deformációja és a T negatív fog
A Kent csomó egy olyan izomhíd, amely szerkezetileg azonos a pitvari szívizomokkal, 1-8 mm-rel mérve. Az átlyukasztja az atrioventrikuláris hornyot, és bejut a kamra szívizomába. Több Kent köteg lehet. Ez kéve (tárcsákon) darab (ok) a szabad fal a pitvarok és a kamrák (parietális kötegek) vagy linkeket (oldott) kamraközti partíciókat a pitvarok és a kamrák (septum gerendák). Ez a WPW jelenség elektrokardiográfiai képéhez vezet (4. ábra).
A James traktus egy izomképződés, amely az interatrialis septum hátsó szakaszaiból származik, és az AV csomópontot tolja le. Egy speciális vezetőrendszerbe kerül az AV csomópont disztális részének vagy a köteg proximális részének szintjén. E csatorna jelenléte a csonkított PQ jelenségének alapját képezi.
A Maheheim szálak összekapcsolják az AV csomópont disztális részét vagy a köteg proximális részét az IVF felső részével.
A szív elektrofiziológiája a szív elektromos aktivitásának ionos alapja. A szív elektrofiziológiájának alapfogalmai közé tartozik a nyugalmi potenciál
Az intracelluláris K + ionok fő része szabad állapotban van és diffúziós együtthatója csak kis mértékben kisebb, mint a K + ionok az extracelluláris térben. Ezért a K + ionok általában elhagyják a sejtet, és a Na + ionok belépnek a sejtbe. A nátrium-káliumszivattyú folyamatosan aktívan szivattyúzza a K + és Na + ionokat elektrokémiai gradiensük ellen, és így támogatja a PP-t. A nátrium-káliumszivattyú aktivitását befolyásolja a sejtmembrán állapota, amelyet egy foszfolipidmolekula réteg képvisel, amely két réteg adszorbeált fehérje között van. Munka natrievokalievogo membrán szivattyú esetén, ATPáz, (Na +, K +) - ATPáz, amely szükséges, hogy aktiválja az ionok Na +, K + ionok, és az ionok Mg2 +.
Az ionok áthatolnak a membránon olyan csatornákon keresztül, amelyek képesek megkülönböztetni a töltéshordozók fajait. A különböző ionok csatornáinak relatív permeabilitása (csatorna szelektivitás) tükröződik az egyensúlyi potenciálban. Egy egyensúlyi potenciál az a potenciál, amelynél a csatornán áthaladó teljes nulla nulla. Ez a potenciál olyan ionkoncentráció-gradiensek függvénye, amelyeknek a membrán permeábilis.
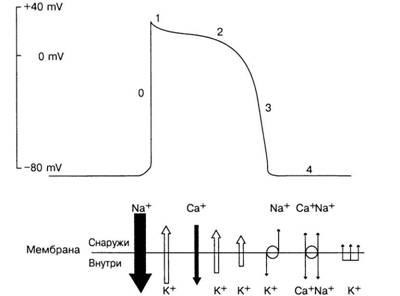
Ábra. 6. Cselekvési lehetőségek
Ha a sejtmembrán, hogy csatolja az elektromos stimulus (. 6. ábra) elegendő erőt, hogy változtatni a PCB a küszöbérték potenciális szint, van egy gyors depolarizációt - hirtelen a töltés megváltozásával a sejteken belül, hogy pozitív (+20 - 30 mV). A depolarizáció ("0" fázis) a Na + ionok gyors bejutása a sejtbe (gyors nátriumáram). A fenti permeabilitás változások, ami a fejlesztés a „0” fázis PD miatt nyitó és záró specifikus membrán csatornák vagy pórusok, amelyeken keresztül ionok könnyen át Na +. Úgy tartják, hogy a munka „kapu” szabályozza a nyitó és záró az egyes csatornák, mely létezhet legalább három konformáció, az „nyitott”, „zárt” és „inaktivált.”
Az ionos nátriumáramok néhány kapuja gyorsan mozog, megnyitva a csatornát, amikor a membrán hirtelen depolarizálódik az inger alatt. Más kapuk lassabban mozognak a depolarizáció során, és funkciójuk a csatorna lezárása. Ahhoz ismertetnek membránnal vezetőképesség Na + (. 7. ábra), a „időfüggő - INa» és «voltage-- INa» (amely folyik keresztül pitvari depolarizáció sejtek His- rendszer - Purkinje kamrai infarktus).
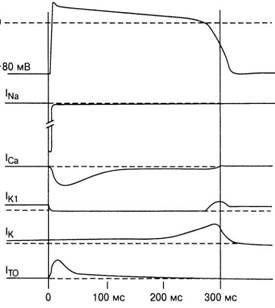
Ábra. 7. Az ionáramok jellemzői a PD periódus alatt: In3 - bejövő Na + -TOK; 1ca - bejövő Ca2 + -áram; Iki - a jelenlegi K + az érzékelő K + csatornákon keresztül; 1k - az aktuális K "a lassú csatornákon keresztül, 1to - ideiglenes áram a cellából a részleges repolarizáció szakaszában
Ha a membrán depolarizált pihen hirtelen arra a szintre, a pozitív potenciált, az aktiváló kapu gyorsan változik a helyzetben, hogy nyissa ki a nátrium-csatornákat, majd lassan inaktivatsionnye kapuk zárt. A "lassú" kifejezés itt azt jelenti, hogy az inaktiválás több milliszekundumot vesz igénybe, míg az aktiválás egy milliszekundumos törtrészekben történik. Az ilyen magas növekedési sebességgel rendelkező PD gyorsan terjed a szíven keresztül, és ez jellemző a működő szívizom sejtjeire (gyors reakciósejtek). A depolarizáció ("0" fázis) után kezdődik a repolarizáció lassú folyamata - az eredeti PP helyreállítása. A normál sejtek számára kardiális nátrium belépő áramok felelős a gyorsan nőtt a PD, egy második bemeneti áram, amely elsősorban által átadott kalciumionok. Ezt az áramot közkeletű nevén „bejövő lassú aktuális”, és átfolyik a csatornák jellemzőinek megfelelően a vezetőképesség attól függően, az idő és a feszültség, úgynevezett „lassú csatornák”. A működő sejtek, a szívizom és His rendszer - Purkinje első szakaszában a repolarizáció (. 6. ábra, a fázis „1”) fordul elő elég gyorsan, és ez annak köszönhető, hogy a kibocsátás a K + ionok és Cl ionok belépő a sejt.
Idő, ms
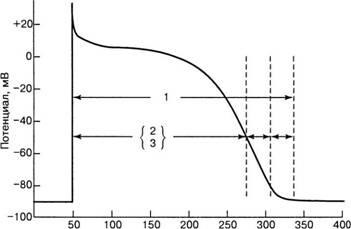
Ábra. 8. Tűzálló időszakok: 1 - teljes visszanyerési idő; 2 - abszolút tűzálló időszak;
3 - hatékony tűzálló időszak; 4 - relatív refrakter periódus;
5 - a szupernormális izgatottság időszaka
Ezt követően (fázis „2”) a háttérben áramok kifelé irányuló K + ionok bekövetkezik bejáratánál Ca2 + ionok (és kisebb mértékben a Na +) a lassan csatornák, ahol a sebességet a depolarizáció és repolarizáció időben kiegyensúlyozott, és van egy plató AP. Mivel a teljes áram szinten a transzmembrán potenciál plató (m. E. A algebrai összes komponensek összege a bejövő és kimenő áramok) egyre Emerging, gyorsabb membránpotenciál eltolódik a negatív irányban, és elindít egy gyors repolarizációs végső szakaszának PD. Végén a plató lassú csatornák kezd bezáródni, és a vezetőképessége K + ionok drámaian növekszik - gyorsított repolarizációs ( „3” fázis), és visszatér az eredeti szintre PP. Ezután kezdődik a diasztolé ("4" szakasz). A membránpotenciál normális dolgozó szívizomsejtek állandó marad a nyugalmi potenciál az egész diasztolé ha ezek a sejtek nem izgatott a szaporító pulzus, a PP ők fenn a végtelenségig.
A depolarizáció és a repolarizáció nagy részében - a 60 mV membránpotenciál szintig - a gyors reakciósejtek (elsősorban az atria és a kamrák működő szívizomsejtjei) teljesen feljogosíthatatlanok. Ezt az állapotot abszolút refrakter periódusnak (ARP) nevezik - 0, 1, 2 fázis PD (8. ábra). AP alatt minden elektromos inger nem okoz PD-t. Az ARP befejezése után a sejt helyreállítja izgatottságát. Ezt az időszakot relatív refrakter period (PPR) nevezik. A PIU-nál csak a megnövekedett erejű ingerek képesek PD-t okozni. Az impulzus sebessége a PIU alatt csökken.
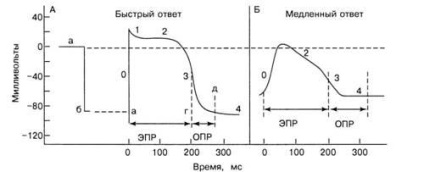
Ábra. 9. Gyors (A) és lassú (B) válaszú sejtek hatásmechanizmusa és refrakter periódusai
A hatékony refrakter periódus (ERP) a két inger közötti minimális időtartam, amikor a második inger nem okoz PD-t. A funkcionális tűzálló periódus (FFR) a két egymást követő impulzus közötti minimális időtartam a szívizom ezen vagy másik részén keresztül.
A refrakció megakadályozza a gerjesztő hullám körforgását a myocardiumon keresztül, megóvva a szívizom túlságosan gyors újra-gerjesztését, ami sértheti a kontraktilis funkcióját.
A CS, AV csomópont és a működő myocardium sejtjeinek elektromos aktivitása különbözik (9. ábra). A CS és az AV csomópont sejtjeit lassú válasz-sejteknek nevezik. A PP - 60 mV. Ezen érték PP gyors nátrium csatorna részben zárt (inaktivált), és a depolarizáció lép fel elsősorban a jelenlegi Ca2 + ionok és a Na + a lassú csatornák, így a fázis „0” PD sejtekben SU és az AV csomópont rendelkezik egy szelíd karakter, a depolarizáció simán repolarizáció.
Az SU és az AV csomópontok képesek az automatizmusra, vagyis a független PD generációra. A CS-sejtek általában aktívak és ritkán nyugalmi állapotban vannak, elektromos aktivitást generálnak ciklikusan, spontán depolarizálva és hiperpolarizálnak, ezért leírásuk során a "PP" kifejezést gyakorlatilag nem használják. A szövetek spontán depolarizációra való képességét pacemaker aktivitásnak nevezik. A három fő tényező határozza meg a természetes impulzus-generációs frekvenciát az SS-ben: a diasztolész maximális potenciálja, a potenciál küszöbértéke, valamint a depolarizációs fázis sebessége és hajlama.
A három tényező bármelyikében bekövetkező változások a "4" szakaszhoz szükséges idő megzavarásához vezetnek. Ez az impulzusgyorsítás sebességét sértheti. Az SU csomópont nem az egyetlen része a szívnek, amely rendelkezik
ez a képesség azonban a legmagasabb frekvenciával van izgatva, ezért normális körülmények között a szívében uralkodó pacemaker. Az AV csomópont pacemaker aktivitása kevésbé hangsúlyos, mint az SS-ben. Más pacemakerek ( „központok automatizmus másodrendű”), az arány a spontán diasztolés depolarizációt, kisülési gyakorisága is kisebb és hívják ektópiás pacemakerek (látens rejtett). Hierarchikus viszonyok között uralkodó és kiegészítő pacemakert úgy, hogy a szívfrekvencia határozza meg a legmagasabb frekvencia generációs PD miokardiális kártyát elnyomja gócok ritka szintű impulzusokat előállító kiszabott ( „bitorolja”) szív saját ritmusát, és így pacemaker ( az automatizmus központja). Az automatizmus függvénye a neurohumorális hatásoktól függ, amelyek meghatározzák az impulzusok spontán generációjának gyakoriságát, a szervezet szükségleteitől függően. SU általában generál elektromos impulzusok frekvenciája 60-80 1 perc, vegyületet AB - 40-60 1 perc, His-köteg lábak - 15-40 1 perc, Purkinje rostokat - január 15-30 perc.
A szív egy részében kialakuló PD (normál SS-ben), a szomszédos sejtekre terjed.
Az alapvető elektrofiziológiai paraméterek, amelyek meghatározzák a sebességet a vezetésre fázissebesség és amplitúdó „0” PD. Sebesség impulzus a munka szívizomban -0,3-1 m / s, egy ág blokk rendszer - Purkinje - akár 4 m / s, a szövetekben SU és A-B-csomópontok -0,02-0,1 m / s.