A génaktivitás szabályozása
Minden szervezet bármely sejtje, függetlenül attól, hogy melyik funkciót végzi, teljes körű génje van a szervezetnek. Ugyanakkor jól ismert, hogy minden szervezetben a különböző szövetek és szervek sejtjei különböznek a benne lévő fehérjékben. Még egy sejtben a fejlődés különböző szakaszaiban különböző fehérjéket szintetizálnak és működnek. Ezért, ha teljes genetikai információval rendelkezünk, minden egyes sejt egy adott fejlődési szakaszban csak azt a részét használja, amelyre jelenleg szükség van, csak azok a gének, amelyek termékei a sejtnek adott időpontban szükségesek a funkciók elküldéséhez, átírják. Következésképpen a sejtnek olyan mechanizmusokkal kell rendelkeznie, amelyek meghatározzák, hogy mely gének és milyen sorrendben kell átírni. A génaktivitás legteljesebb szabályozása az adaptív enzim szintézis példáin keresztül történt mikroorganizmusokban. Nézzük meg néhányat.
A körülményektől függően a baktériumsejtben lévő bizonyos enzim mennyisége jelentősen változhat. Néhány enzim, amely a baktériumok számára szükséges bizonyos tápanyagok asszimilálására, aktívan szintetizálódik a sejtben csak akkor, ha ezek az anyagok a tenyésztőközegben jelen vannak, és a szintézis megszűnik, ha bármilyen módon eltávolítják a környezetből. Ez a fajta szabályozás
Az enzim szintézisét indukciónak nevezzük, és az ezt a szintézist okozó anyagot induktornak nevezzük. Az egyik legjobb példa erre a típusú szabályozás - a laktóz operon az E. coli - egy csoport gének, amely vezérli a szintézis enzimek végző katabolizmus laktóz - laktóz. Csak néhány perccel a beadagolás után a táptalaj az E. coli laktóz baktériumok kezdenek termelni három enzimet: galaktozidpermeazu, béta-galaktozidáz, és galaktozidtransatsetilazu. Amint a környezetben lévő laktóz erőforrása kimerült, az enzimek szintézise azonnal megszűnik.
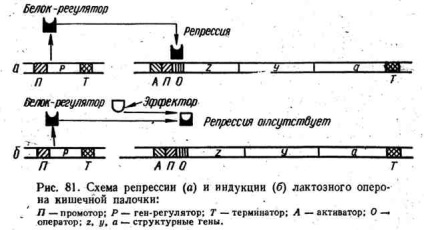
A fenti példa jobban érthető lesz, ha figyelembe vesszük a rendszer a munka a laktóz operon (ábra. 81), a tanulmány, amely lehetővé tette a francia tudós, F. Jacob és J. Monod kifejlesztette saját koncepcióját az operon, és megtudja, az alapelveket a transzkripció szabályozásában prokarióták. Az operon az A. helyről indul ki, amely bizonyos aktivátorfehérjékhez kapcsolódik, amely viszont az A helyet követõen az RNS polimeráz promoteréhez (R) való kapcsolódáshoz szükséges. A promóter szekvencia nukleotidok amely RNS polimeráz által felismerhető, hogy az üzemeltető (O), amely fontos szerepet játszik a gén transzkripció operon, mivel kötődik szabályozó represszor fehérjét. Az operátort a három fent említett enzim szerkezeti génjei követik. Az operon az RNS polimeráz előrehaladását leállító terminátorral és az operon transzkripciójával fejeződik be. Szabályozó fehérje represszor.
Kis mennyiségben folyamatosan szintetizálódik a sejtben, így a citoplazmában ugyanabban az időben nem több, mint 10 molekula. Ez a fehérje affinitása van a nukleotidok szekvenciájához az operátor területén, és ugyanaz a laktóz affinitása. Laktóz hiányában a fehérje-represszor kötődik az operátor helyéhez és megakadályozza az RNS polimeráz DNS előrehaladását: az mRNS szintetizálódik, és az enzimeket nem szintetizálják. Laktóz hozzáadása a táptalajhoz, a protein-represszor gyorsabban kötődik hozzá, mint az operátor helyén: ez utóbbi marad szabad, és nem zavarja az RNS polimeráz előrehaladását. Van egy átírás és fordítás. A szintetizáló enzimek a sejtbe szállítanak és laktózt emésztenek. Miután az összes laktózt elfogyasztották, nem lesz semmi, ami megköti a fehérje-rap tavaszt, és újra kapcsolatba lép az operátorral, megállítva az operon átírását. Így az operon indukcióját az okozza, hogy a szabályozó fehérje nem kapcsolódik az operátorhoz. Ezt az indukciót negatívnak hívják.
Egy másik ismert típusú indukció a pozitív indukció. Különös egy másik kolibacillus, amely más cukor - arabinóz katabolizmus enzimjeit kódolja. Ez az operon szerkezetileg nagyon hasonlít az előzőhöz. A különbség a szabályozás adunk a táptalajhoz, hogy kölcsönhatásba lép a fehérje arabinóz represszor és operátor felszabadító része egyidejűleg fordul represszor fehérje aktivátor fehérje, amely elősegíti tapadását RNS-polimeráz a promoterhez. Ilyen körülmények között az átírás történik. Miután a készletek kimerüléséig arabinóz a közegben, szintetizálni a fehérje-rap rugók ismét kommunikál az üzemeltető kikapcsolja a transzkripció.
Az indukció mellett kétféle (negatív és pozitív) represszió elvének szabályozása is ismert. Ha negatív indukcióval az effektor (induktor) megakadályozza, hogy a represszor fehérje kapcsolódjon az operátorhoz, akkor negatív elnyomás esetén éppen ellenkezőleg, az effektor biztosítja a szabályozó fehérje számára, hogy csatlakozzon a kezelőhöz. Ha az első esetben az effektor és a szabályozó fehérje összekapcsolása lehetővé tette a transzkripciót, akkor a másodikban megtiltja. A negatív elnyomás egyik példája az Escherichia coli jól megvizsgált triptofán operonja. Öt szerkezeti génből áll, amelyek az aminosav triptofán, az operátor és a két promoter szintézisét biztosítják. A fehérje szabályozó a triptofán operonon kívül szintetizálódik. Míg a sejt kezeli az összes szintetizált triptofánt, az operon működik, folytatódik a triptofán szintézise. Ha a sejtben felesleges triptofán jelenik meg, akkor a szabályozó fehérjével kombinálódik, és oly módon változtatja meg, hogy ez a fehérje megszerezze az affinitást az operátorral. A módosított fehérje szabályozó kölcsönhatásba lép az operátorral és megakadályozza a szerkezeti gének transzkripcióját, aminek következtében a triptofán szintézise megszűnik. Pozitív elnyomás esetén az effektor megfosztja a szabályozó fehérjét az operátorral való kommunikáció képességétől, ezáltal a szerkezeti gének transzkripcióját okozza.
A leírt szabályozási típusok jellemzik az egyes operonok szabályozásának mechanizmusát, gyakorlatilag anélkül, hogy megérintenék a genomkifejezés egészének szabályozását, bár nyilvánvaló, hogy a különböző operonok szabályozásának koordinált természetűnek kell lennie. A különböző operonok és gének munkájának összehangolt természetét a vírusok és fágok kaszkádszabályozásának nevezték. Elve szerint a szabályozás kaszkád első transzkripciós „azonnali korai”, majd a „korai” és végül a „késői” gének, attól függően, hogy milyen fehérjék szükségesek különböző szakaszaiban vírus (fág) fertőzés.
Természetesen a fágok kaszkád szabályozásának elve a legegyszerűbb. Az összetettebb organizmusokban számos olyan függvény végrehajtásához, amelyek egyidejűleg vagy egy bizonyos sorrendben fordulnak elő, sok gén és operon összehangolt munkája szükséges. Ez különösen igaz az eukariótákra, amelyek nemcsak a genom bonyolultabb szervezésében különböznek, hanem a génaktivitás szabályozási mechanizmusainak számos más jellemzőjében is.
Szerint a rendelet elveinek eukarióta gének lehet három csoportba sorolhatók: 1) működésének minden a test sejtjeiben; 2) csak azonos típusú szövetekben működik; 3) konkrét funkciókat ellátó specifikus sejtek biztosítása. Továbbá, eukariótákban off ismert csoport egyidejű gén aktivitás, hajtjuk hisztonok - bázikus proteinekkel, amelyek tagjai a kromoszómák. Egy másik jelentős különbség a transzkripció eukarióták, hogy sok mRNS fennállhat hosszú ideig a sejt formájában speciális részecskék-informosom, miközben gyakorlatilag prokarióták mRNS transzkripció során adja meg a riboszóma, broadcast, majd gyorsan elbomlanak.
Vannak azonban olyan sok adat azt jelzi, hogy a transzkripció az eukariótákban végezzük részek, és a prokarióták, mint operonok álló szabályozási és strukturális gének. A megkülönböztető jegye eukarióta operon az, hogy szinte mindig tartalmaznak csak a strukturális gén és a szabályozó gének különböző szakaszaiban adott lánc metabolikus átalakulások mentén elszórt kromoszóma és még különböző kromoszómákon. Egy másik funkció operonok eukariótákban az, hogy áll egy jelentős (exonok) és a nem-szignifikáns (intronok) részletekben váltakozva egymással. Amikor transzkripciós olvasni, mint exonokat és intronokat, és a kapott információt a prekurzor RNS-t (pro-mRNS) megy át, érés (feldolgozás), amelyek képződését eredményezi és az öregedés Introitus megfelelő mRNS-ek (splicing)
Eukariótákban a génaktivitás egyéb szabályozási módjai ismertek, például pozícióhatás vagy dózis-kompenzáció. Az első esetben ez a változás a gén aktivitásában, attól függően, hogy az adott környezetben: mozgó gén egyik helyről a másikra kromoszóma vezethet változást a tevékenység mind a gén és a közelben. A második esetben a hiányzó egyetlen dózis vagy gén (az első helyen a kifejezés olyan géneket lokalizálva nemi kromoszómák heterogametic szex, amikor az egyik homológ nemi kromoszómák vagy genetikailag inert, vagy teljesen hiányzó) fenotípus nem fordul elő miatt kompenzációs aktivitásának növekedését a fennmaradó gén . Általánosságban az eukarióták génaktivitásának szabályozását nem vizsgálták megfelelően.