Az izomrost szerkezete és csökkentése
Az élettani rendszer izomösszehúzódása mechanokémiai folyamat. A modern tudomány a biológiai mobilitás legtökéletesebb formáját tartja számon. Az izomrost biológiai tárgyak csökkentése "kifejlesztett" az űrben való mozgásmódnak (ami nagyban növelte életképességüket).
Az izomösszehúzódást a feszültség fázisa előzi meg, amely a kémiai energia közvetlen mechanizmussá és jó hatásfokkal (30-50%) történő átalakításával valósul meg. A potenciális energia felhalmozódása a feszültség fázisában az izomot az esetleges, de még nem realizált összehúzódás állapotába vezette.
Az állatok és az ember ott (és az a személy úgy véli, hogy a tanulmányozott és) a két alaptípusa izom: harántcsíkolt és gladkie.Poperechnopolosatye izom- vagy csontváz kapcsolódik a csontok (kivéve a harántcsíkolt szálak a szívizom, amelyek eltérnek a vázizom és összetétele). A Gladkitamish fenntartja a belső szervek és a bőr szöveteit, és az erek falának izomzatát képezi, valamint a beleket.
A sport biokémiájában a vázizmokat tanulmányozzák. "Különösen felelős" a sport eredményért.
Az izom (mint egy makro objektumhoz tartozó makro entitások) egyéni izomrostokból (mikroformációkból) áll. A több ezer férfi izomzatában az izom erőfeszítés integrális érték, összefoglalva az egyes szálak összehúzódását. Háromféle izomszál van: fehér, gyors vágású, közepes és vörös lassan összehúzódik. A szálak típusai különböznek az energiaellátás mechanizmusában, és különböző motoneuronok vezérlik. Az izmok típusai különböznek a szál típusok arányában.
Egyetlen izomfájl-filiform, sejt nélküli forma egy szimplaszt. A ketrecben a szimplaszt "nem úgy néz ki": nagyon hosszúkás alakú, hosszúsága 0,1-3 cm, egy sartoriális izom 12 cm-ig, vastagsága pedig 0,01-0,2 mm. A symplastot héj-sarcolemma veszi körül, amelynek felszínén számos motor idegi ablakai alkalmasak. Sarcolemma - egy kétrétegű lipoprotein membrán (10 nm vastagságú), amelyet kollagénszálak hálózata erősített meg. Ha összehúzódás után megnyugodik, visszaadják a symplast eredeti alakját (4. ábra).
Ábra. 4. Külön izomrost.
A sarcolemma membrán külső felületén az elektromos membránpotenciál mindig fennmarad, nyugalmi állapotban is 90-100 mV. A potenciális rendelkezésre állás előfeltétele az izomrostok kezelésének (mint egy autó akkumulátor). A potenciális készítette az aktív (és ezáltal az energia költségek - ATP) anyagok szállítására a membránon keresztül szelektív permeabilitás (elvileg - „aki akar - és elismerem, vagy kiadja a„). Ezért a symplaston belül egyes ionok és molekulák nagyobb koncentrációban halmozódnak fel, mint kívül.
A sarcolemma jól áteresztő a K + ionokkal szemben - belül felhalmozódnak, és a Na + ionok kívülről szabadulnak fel. Ennek megfelelően a Na + ionok koncentrációja az intercelluláris folyadékban nagyobb, mint a K + ionok koncentrációja a symplaston belül. Offset pH a savas oldalon (a kialakulását tejsav, például), hogy növelje a permeabilitást a szarkolemma makromolekuláris anyagok (zsír-TION savak, fehérjék, poliszacharidok), amely a normál állapotban nem adja át rajta. Könnyen átjuthat (diffúz) a kis molekulájú anyagok (glükóz, tej és piruvinsavak, keton testek, aminosavak, rövid peptidek) membránján keresztül.
A belső a symplast - szarkoplazma - etokolloidnaya fehérje szerkezete (emlékeztet a zselés konzisztencia). Felfüggesztett benne vannak felvételét glikogén, zsír csökken, akkor „beépített” a különböző subkle finom részecskék: a sejtmag, mitokondrium, miofibrillumok, riboszómák és mások.
A kontraktilis "mechanizmus" a szimfázis-miofibrillumon belül. Ezek vékony (Ø 1 - 2 μm) izomszálak, hosszúak - közel azonosak az izomszálak hosszával. Azt találtuk, hogy a symplasts képzetlen izom miofibrillumok rendezett elhelyezni nem mentén symplast, de a terjedését és az eltéréseket, és a képzett - miofibirilly orientált a hosszanti tengely mentén, és tovább csoportosítva kötegek a kötelek. (Ha forog szintetikus szálak és szintetikus polimer makromolekula először mentén elhelyezett szál nem szigorúan és sportolók „kemény vonat” - orientált helyesen - a szál tengelyével ismételt felhúzás: lásd bolt leghosszabb Žive és a „Chemical Fibre”).
Egy fénymikroszkópban megfigyelhető, hogy a miofibrillák valóban "keresztirányban csíkozottak". Vannak alternatív világos és sötét területek - lemezek. Sötét lemezek A (anizotróp) fehérjék többet tartalmaznak, mint a könnyű lemezek I (izotróp). A könnyű lemezeket Z (telaphragmák) membránokkal keresztezik, és a két Z-membrán között a miofibrillum régiót sarcomernek nevezik. A miofibrillum 1000-1200 sarcomérból áll (5. ábra).
Az izomrost egészének csökkentése az egyes szarkóma csökkentéséből áll. Minden egyes darabolással, a sarcomerek együttes erőfeszítést eredményeznek és mechanikus munkát végeznek az izmok csökkentése érdekében.
A sarcomér hossza mérettartományban 1,8 μm-ről 1,5 μm-re, mérsékelt és 1 μm teljes redukcióval változik. A sarcomerek, sötét és könnyű lemezek tartalmaznak protofibrillákat (myofilamentek) - fehérjefonalas struktúrákat. Két típusa van: vastag (Ø - 11 - 14 nm, hossza - 1500 nm) és vékony (Ø - 4-6 nm, hossza - 1000 nm).
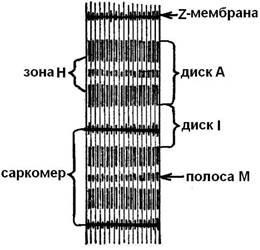
Ábra. 5. A miofibrillák helye.
Bright kerekek (I) kizárólag az alábbiak vékony protofibrilek és sötét kerekek (A) - a protofibrilek két típusa: vékony membrán kapcsolódik egymáshoz, és vastag, koncentráljuk egy külön zónában (H).
A csökkentés A hossz sötét lemez (A) nem változik, és a hossza a fény lemez (I) csökken, mivel vékony protofibrilekhez (fény lemezek) benyomjuk a terek között, a vastag (sötét lemezek). A protofibrillák felszínén különleges kiolvasások vannak - tüskék (körülbelül 3 nm vastag). A "munkapozíció" -on keresztmetszet (keresztirányú hidak) állnak a vastag és vékony protofibrillák között (6. ábra). A csökkentés Z -membrany felfekszenek a végén a vastag pro-tofibrill és vékony protofibrilekhez is lehet seb körül vastag. Amikor sverhsokraschenii végeit vékony szálak a közepén a sarcomer vannak csomagolva, és a végén a vastag protofibrilek - gyűrött.
Ábra. 6. Az aktin és a miozin közötti tapadás kialakulása.
Tápegység izomrostok révén a szarkoplazmatikus retikulum (ez - szarkoplazmatikus retikulum) - egy olyan rendszer hosszanti és Pope-folyó csövek, membránok, buborékok rekeszek.
A szarkoplazmatikus hálózatban különböző biokémiai folyamatok szervezett és ellenőrzött módon zajlanak, a hálózat magában foglal mindent, mind pedig mindegyik myofibrill külön-külön. A retikulum tartalmazza a riboszómákat, a fehérjék szintézisét és a mitokondriumokat - "sejtenergia-állomások" (az iskolai tankönyvben meghatározottak szerint) végzik el. Valójában a mitokondriumok a myofibrillák között vannak kialakítva, ami optimális feltételeket teremt az energiaellátás számára az izomösszehúzódás folyamatában. Megállapították, hogy a képzett izomban a mitokondriumok száma nagyobb, mint a nem képzetteknél.
Az izmok kémiai összetétele.
A víz az izomtömeg 70-80% -át teszi ki.
Fehérjéket. On dolyubelkovprihoditsya ot17 21% izom tömeg: körülbelül 40% a izomfehérjék koncentrálódnak a miofibrillumok, 30% - a szarkoplazmatikus 14% - a mitokondriumokban, 15% - a szarkolemmából, a másik a sejtmagban, és egyéb sejtes ORGA-Nelly.
Nitrogénmentes vegyületek. Az izmok szénhidrátokat, glikogént és metabolitjait, valamint zsírokat, koleszterint, keton testeket, ásványi sókat tartalmaznak. Az étrendtől és a testmozgás mértékétől függően a glikogén mennyisége 0,2-3% között változik, míg a képzés növeli a szabad glikogén tömegét. Az izmok kiégett zsírok felhalmozódnak a kitartás során. A proteinhez kötődő zsír kb. 1%, az izomrost membránjaiban pedig legfeljebb 0,2% koleszterint tartalmazhat.
Ásványi anyagok. Az izomszövet ásványianyagai az izomtömeg körülbelül 1 - 1,5% -át teszik ki, alapvetően a kálium, a nátrium, a kalcium, a magnézium sói. Ásványi ionok, például K +. Na +. Mg 2+. Ca 2+. Cl -. NR04
fontos szerepet töltenek be az izomösszehúzódással járó biokémiai folyamatokban (ezek szerepelnek a "sport" adalékanyagokban és ásványvízben).
Izomfehérjék biokémiája.
A fő kontraktilis izomfehérje, a miozin, a fibrilláris fehérjékre utal (molekulatömeg körülbelül 470000). Fontos jellemzője a miozin - képes komplexet képez az molekula ATP és ADP (amely lehetővé teszi, hogy „válassza ki a” származó energiát ATP) és a fehérje - aktin (amely lehetővé teszi, hogy a csökkenés).
A miozin molekula negatív töltésű és specifikusan kölcsönhatásba lép Ca ++ és Mg ++ ionokkal. A miozin Ca ++ ionok jelenlétében gyorsítja az ATP hidrolízisét, és ezáltal enzimatikus adenozin-trifoszfát aktivitást mutat:
A miozin fehérjét két azonos, hosszú polipeptid alkotja # 945; -csíkok, csavart, mint egy dupla helix, Fig. Proteolitikus enzimek hatására a miozin molekula két részre bomlik. Az egyik része képes aktin-kötődéssel kötődni, ami aktomyozint alkot. Ez a rész felelős az adenozin-trifoszfatáz aktivitásért, amely a táptalaj pH-jától függ, az optimális pH-érték 6,0-9,5, valamint a KCl koncentrációja. A komplex - actomyosin szétesik ATP jelenlétében, de szabad ATP hiányában stabil. A myosin molekulájának második része két csavart spirálból is áll, az elektrosztatikus töltésnek köszönhetően a miozin molekuláit a protofibrillekhez kötik.
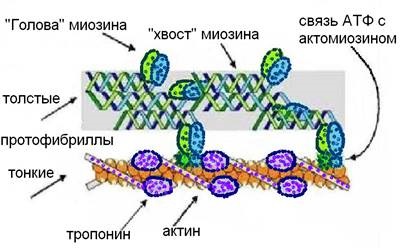
Ábra. 7. A actomyosin szerkezete.
A második legfontosabb kontraktilis fehérje az aktin (7. ábra). Három formában létezhet: monomer (globularis), dimerikus (globularis) és polimer (fibrilláris). A monomer gömbölyű actin, amikor polipeptidláncai sűrűn kompakt gömb alakúak, az ATP-hez társul. Hasítás ATP aktin monomerek - A forma dimereket tartalmazó ADP: A - ADP - A. polimer fibrilláris aktin - kettős spirál, amely dimerek, ábra. 7.
Az Actin globuláris fibrillárisvá alakul K + ionok jelenlétében. Mg ++ és fibrilláris aktin dominál az élő izmokban.
A myofibrillák jelentős mennyiségű tropomi-zin-proteint tartalmaznak. amely két - # 945; - spirális polipeptid láncok. A pihentető izmokban aktin komplexet képez, és blokkolja aktív központjait, mivel az aktin képes kötődni Ca ++ ionokhoz, és eltávolítja ezt a blokkot.
Molekuláris szinten, a vastag és vékony protofibrilekhez szarkomer elektrosztatikus kölcsönhatásba lép, mert különleges helyszínek - kinövések és kiálló részek, ahol a díjat. At szakasz vastag lemez protofibrileket épülnek a köteg hosszirányban orientált molekulák miozin vékony protofibrilekhez radiálisán vannak elrendezve körül vastag, amely egy hasonló struktúrát az átállási kábel. A központi M-sávos vastag protofibrileket miozin molekulák Conn-Nena a „farok”, és színészi „fej” - kinövések különböző irányba mutató és helyezkednek el a nagy-Villeneuve spirális vonalakat. Valójában a fibrilláris aktin spiráljaiban, egymástól bizonyos távolságban, monomer aktin globulák is vannak. Minden vetületben van egy aktív központ, amely miatt a miozinnel adhézió képződhet. A sarcomerek Z-membránjai (váltakozó talapzatokként) a finom protofibrilleket rögzítik.