A diákok fiziko-matematikai társadalma - a döntés problémái
Feladatok megoldással. Termodinamika.
1) ideális gáz, amelynek tömege m és moláris tömege μ. bővül és zobarno egy bizonyos nyomás. A gáz kezdeti hőmérséklete T1. végleges T 2. Határozza meg a gáz által végzett munkát.
A megoldás.
Munka az izobár folyamatban
A Mendeleev-Clapeyron egyenletből
Kiderült, hogy az izobárikus folyamatban végzett munka nemcsak a térfogat változtatásával, hanem a hőmérséklet változtatásával is kifejezhető:
Az eredményt szem előtt kell tartani, mivel gyakran bonyolultabb problémák megoldására használják.
válaszolni:
2) Héliumot (He) állandó nyomáson melegítünk. Ugyanakkor, Q = 20 kJ hőt jelentenek neki. Határozza meg a gáz belső energia változását és az általa végzett munkát.
A megoldás.
Mivel a probléma állapota p = const. akkor a gáz által végzett munka, ahol m a gáz tömege, μ a moláris tömege, # 8710; T a hőmérsékletváltozás.
A hélium egy monatomgáz, ezért belső energiája és variációja Az A munka formuláinak összehasonlítása és a belső energia változása # 8710; U. Megkapjuk, hogy a folyamat termodinamika első törvényét jegyezzük fel:
Következésképpen a belső energia megváltoztatása
válaszolni:
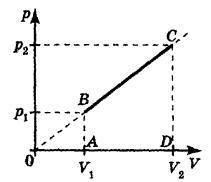
3) A μ móltömegű ideális gáz tömegének m-es h mérséklete változik azon a törvény szerint, ahol a = const> 0. A gáz teljesítményét a V1-től a V2-ig terjedő térfogat növekedésével határozza meg. Hő elnyeli vagy felszabadul ebben a folyamatban?
megoldás:
Az eljárás nem izobarikus, nem izokori, sem izotermikus. Mi a Mendeleev-Clapeyron egyenletet írjuk le bármelyik állam számára ebben a folyamatban: Azóta a helyettesítés után kapjuk meg a nyomás-térfogat függését a formában. A függvény grafikáját az ábrán mutatjuk be.
Gázhatékony munka
A probléma második kérdésének megválaszolásához a termodinamika első törvényét alkalmazzuk: Mivel a gáz kibővül, az A> 0 munkája. Az ideális gáz belső energiájának változása arányos a hőmérsékletváltozással: # 8710; U
# 8710; Mivel a térfogat is nő, a hőmérséklet is így van # 8710; U> 0. Ezután Q> 0, ami megfelel a gáz hő általi felszívódásának.
4) Amikor az adiabatikus kompresszió 1 mól egyatomos gázok történt a külső erők által munka A. hányszor megnövekedett effektív sebessége a gázmolekulák, ha a kezdeti gáz hőmérséklete T 1?
A megoldás.
Az adiabatikus folyamat termodinamika első törvényét 0 = # 8710; U + A '. ahol # 8710; U a gáz belső energiájának változása, és A 'a gáz munkája ebben a folyamatban. Mivel a gáz összenyomódott, A '<0. в то же время внешние силы совершают положительную работу А, причем А' = -А. Следовательно, Внутренняя энергия 1 моля идеального одноатомного газа поэтому . Отсюда выражаем конечную температуру газа
A molekulák átlagos kinetikus energiája ahol T a hőmérséklet. Aztán az effekt sebességét
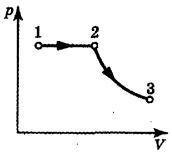
megoldás:
Állítsunk össze egy ábrát a nyomás, illetve a térfogat függvényében a p, V (ábra) tengelyeknél: 1-2 - izobar melegítés, a térfogat növekedésével együtt; 2-3 - adiabatikus terjeszkedés. Munka az adiabatikus folyamatban
mert
ezért
A gáz által termelt hő mennyisége az izobár folyamatban:
Az (1) képlet szerinti hőmérséklet-különbség helyettesítve azt találjuk
válaszolni:

6) A T hőmérsékleten egy ideális gáz tömege m izohómmal lehűlve úgy, hogy a nyomás n-rel csökken. Ezután a gáz állandó nyomáson növekszik. A végső állapotban hőmérséklete megegyezik a kezdeti hőmérsékletével. A gáz móltömege μ. Határozza meg a gáz által végzett munkát.
A megoldás.
A folyamat grafikonját az ábrán mutatjuk be. Itt 1-2 izokórát, 2-3 izobárt. A kívánt munka, ahol A 1 _2 - a helyszínen 1-2, és az A2-3 - dolgozik a helyszínen 2-3. A 1-2 V-const szakaszban. ezért A1-2 = 0. A 2-3 p = const elemet és az ilyen kifejezéseket úgy alakítjuk át, hogy a térfogat szerinti nyomásterméket szétválasszuk abban az állapotban, amelyben a hőmérsékletet beállítjuk:
A Mendelejev-Kleiperon-egyenletből a 3. állapotra vonatkozóan ezt találjuk
Mivel az 1-es állapotról a 3-as állapotra lehetséges az 1-3 izoterma mentén haladni (ebben az esetben azt mondjuk, hogy az 1. és a 3. pont ugyanazon az izotermen helyezkedik el). A Boyle-Mariotte törvény szerint
Miután az (1) képletben megadtuk, megkapjuk
válaszolni:
1,484,303 egyedi látogató