Az enzimreakciók sebességét befolyásoló tényezők
a többlépcsős folyamat sebessége, amely a polienzim rendszerben történik. a köztes termékek koncentrációjától, valamint a konc. a megfelelő enzim és kofaktor. A sebesség minden egyes szakaszában határozza meg egy rögzített vége-ek a közbenső termék, és a koncentrációt a megfelelő enzimet. Helyhez kötött conc. Az összes közbenső és kofaktorokat meghatározott sebességgel arányát kialakulásuk és a fogyasztás nem csak attól függ aktivitását néhány enzim rendszerek, hanem más enzimatikus sebességek p-TIONS, be amelyek ezeket a vegyületeket alkalmazzuk.
Enzimaktivitást a szervezetben, és a födém-a sebesség, hanem enzimatikus p-TION befolyásolja számos tényező: az affinitása a szubsztrát, az állandó Mihaelesa. hőmérséklet, a közeg pH-ja, konc. szubsztrát és bomlás. cofactors. az enzimek működéséhez, az aktivátorok és inhibitorok jelenlétéhez.
A koenzimek különleges szerepet játszanak az enzimaktivitás szabályozásában.
Hiányos koenzimek és kofaktorok hiányában a szervezetben az enzimek aktivitása csökken.
Az enzim aktivitása függ a konc. szubsztrát. részt vesz az enzimatikus szakaszban. Amikor a p-állapot áll, akkor a hordozót ugyanolyan sebességgel tápláljuk be, mint amit a p-tion használ. A szubsztrátum koncentrációjának növelésével a p-ion gyorsulása új egyensúlyi állapotba kerül, ahol az új p-ion arány egy új szubsztrátkoncentrációnak felel meg.
A polienzimrendszerek ismertek. amelyben az enzimreakciók sebességét a végtermék koncentrációja szabályozza az egymást követő transzformációk láncolatában. Az alapja az ilyen típusú szabályozás gátlás (vagy aktiválása) 1 enzim-nek való bioszintézisének lépései végén termékek úgynevezett p-TION gátlás (vagy aktiválása) a visszacsatoló típusú. A visszacsatolás alapjául szolgáló inhibitorokat és aktivátorokat effektornak nevezzük.
20 osztályozása az enzimes reakciók sorrendben. Chem p-CIÓ, a proish bio rendszerek vannak osztva Molekuláris és általános eljárás. A Mol-st-t a kémiai transzformációkban résztvevõ részecskék száma határozza meg. A reakciókat az elemi cselekmények bevonásával 1, 2 vagy 3 részecskéket nevezzük mono-, bi- és trimolekuláris p-TIONS. Az ütközés valószínűsége több mint 3 kis részecskék és p-CIÓ fordul elő több elemi lépésből áll. A biológiai rendszereket mono- és bimoláris r-tions jellemzi. A reakciók fontos jellemzője a sebesség. A kémiai folyamat sebessége az anyag C időbeli növekedése vagy csökkenése. Az egyes külső körülmények közötti ütközések száma a reagáló anyagok koncentrációjának függvénye. Külső körülmények - hőmérséklet, nyomás, környezet. Ennek eredményeként, p-TION része a kiindulási molekulák fogyasztott a termék képződés p-CIÓ és a C ref-csökkenő, az arány a p-CIÓ csökken. Ez az oka annak, hogy a mono- és bimolekuláris p-dionok folyamatosan csökkenő sebességgel jönnek.
Ha a p-tion aránya független a C reagensektől, akkor zérus sorrendű reakciónak nevezik. Tegyük fel, hogy az A-a alakítjuk olyan mennyiségű egy sebességgel, amely független az anyag A. példa C lehet enzimatikus p-TION húzódó körülmények között feleslegben szubsztrát. Ennek a folyamatnak a kinetikus egyenlete a következőképpen alakul:
Ennek az egyenletnek a megoldása a lineáris időfüggvény:
b = k0 t + C2. ahol C az integrációs állandó
-Ko t, mert koncentráció csökken
Ko t, t. koncentráció növekszik
Annak érdekében, hogy ezek az egyenletek a gyakorlatban alkalmazhatók legyenek, meg kell találni a C értéket a t = 0, a = a0, b = 0 határfeltételek mellett.
Az elsőrendű reakció olyan eljárás, amelynek sebessége az egyik koncentrációtól (az egyik anyag C-től) függ. Az A anyagot B anyagmá kell átalakítani a K1 sebességgel.
Az egyenlet megoldása yavl. Felhasználható:
a feltétel kezdetén t = 0, a = a0, b = 0, C1 = a0. B-től B-ig az a + b = a0, b = a0-a anyag megőrzésének törvényéből származunk. Grafikai rajzok r-tion nyomvonal:
A másodrendű P-tion egy olyan folyamat, amelynek sebessége a bekövetkező reakciókoncentrációtól függ. Tegyük fel, hogy az A és a B értéke C értékkel rendelkezik a K2 sebességgel. Az x-ek számát x-vel jelöljük a t idő szerint. Minden ilyen a-x lesz ugyanaz (mint a szigetek kölcsönhatás vonatkozásában 1: 1) alkotnak .Kin ur: dx \ dt = k2 (a0 - x) (b0 - x) a reagensek közül az első, a második n-sugár p-ionja áthalad az első rend p-rendszerminjen keresztül, mivel C, például az in-Va változik.
A biológiai folyamatok kinetikájának egyik jellemzője a p-tion sebességét befolyásoló szerek rendszerében való jelenléte. Ezek közé tartoznak a biokémiát katalizáló enzimek. átalakulás. Az enzim kinetikája vizsgálja a reagáló anyagok és körülmények kémiai természetére gyakorolt hatás törvényeit. kölcsönhatásukat a p-tions arányával. A vegyi anyag sebességén. P. befolyásolja a következő tényezőket:
-t 0. v a p-arányok növekedése növekvő hőmérsékleten egy bizonyos határig nő.
-Mivel az enzimek Co-enzimeket és fémeket tartalmaznak, a p aránya a Co-enzimek és fémek koncentrációjától függ.
-jelenlét a rr-r-ben. aktivátorok és enzimgátlók.
A p-tions aránya betartja a törvényt, amely szerint a reakció gyorsabban halad, annál inkább a conc. in-ben. Tegyük fel, hogy van egy A + B C + D p-tion
v1 arányos a C és D v1 koncentrációjának A és B koncentrációjának termékével. k1 a sebességi állandó. ez a normalizált sebesség, azaz. egyenlő a p-ion arányával a reagensek koncentrációjában = 1.
Ha van kémiai egyensúly. azaz v1 = v-1, akkor írhatunk:
rossz - az egyensúlyi konstans -a egyenlő az egyensúlyi egyensúlyi egyensúlyi állapot egyensúlyi állapotában.
A XX. Század elején megállapították, hogy ha az F koncentrációja fennmarad. t-const, és a szubsztrát kezdeti koncentrációja nagymértékben változik. akkor a p-tion kezdeti sebességében bekövetkező változást telítettséggel egyenes vonalban fejezzük ki:
Ez a görbe mutatja. hogy a függőség kezdetben közel áll a lineárishoz (alacsony szubsztrátkoncentrációk esetén), majd eléri a maximális értékét. p-CIÓ az elsőrendű alacsony koncentrációjú szubsztrát átalakul a nulladrendű p-TION (t.e.pri amely p-TION üteme független konc. reagál-a-H), az arány a p-ció arányos az enzim koncentrációja. Mat. Az F-es katalízis modellt Michaels és Menten 1913-ban fejlesztette ki. a folyamatok kétlépcsős folyamatát javasolják:
E + S ES E + P. ahol P a termék, az S-szubsztrát, az E-enzim.
az első lépésben, egy reverzibilis enzim-szubsztrát komplex, amely azután bomlik irreverzíbilisen a végtermék F, és felszabadítja a molekulát, hogy részt vegyenek a következő ciklusban. A reagáló anyagok koncentrációjának kinetikai változása a következő formában jelenik meg: ds \ dt = -k2 es + k -1 (es)
dp \ dt = k1 (es) = - ds \ dt
hogy megoldja ezt az egyenletrendszert. a rendszer lezárásának további feltételeit szabjuk meg. p marad a reakcióban. Az F molekulák teljes száma szintén állandó.
ezen adatok felhasználásával a c-egyenleteket az alábbiak szerint írjuk:
megadjuk a határfeltételeket: t = 0, t (es)
ez azt jelenti, hogy a komplex (ek) kinetikus görbéje maximumot tartalmaz. A származék max. des \ dt = 0 az E + S Es E + P folyamat stacionaritási feltétele
a des \ dt = 0 egyenlet megoldása:
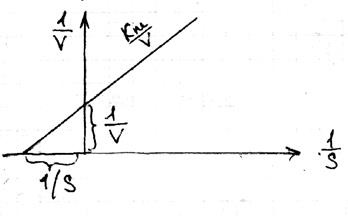
23 Lainuver-Burke egyenlet
A dimenzió és a fizikai jelentés alapján Km a szubsztrátum koncentrációja. amelynél a szubsztrát molekulájának fele, amelyben az enzim molekuláinak fele komplex állapotban van. Az enzimatikus folyamat stabilitása akkor történik, ha a szubsztrát versenye nagyobb, mint az enzim versenye, azaz a tartály folyamatos áramlása és a termékek kiáramlása. A p-tion sebességére
Nagyon nagy koncentrációjú S, Vmax Vmax S \ (k m + S)
Lynuver és Burke azt javasolta, hogy lineáris formában mozogjanak. ahol az inverz kapcsolat látható: 1 \ v = 1 \ vmax (km \ S +1) a Lynuwer-Burke egyenlet.
Ez a legkényelmesebb a teszteléshez:
A biológiai folyamatok kinetikájának egyik jellemzője a p-tion sebességét befolyásoló szerek rendszerében való jelenléte. Ezek közé tartoznak a biokémiát katalizáló enzimek. átalakulás. Az enzim kinetikája vizsgálja a reagáló anyagok és körülmények kémiai természetére gyakorolt hatás törvényeit. kölcsönhatásukat a p-tions arányával. A vegyi anyag sebességén. P. befolyásolja a következő tényezőket:
-t 0. v a p-arányok növekedése növekvő hőmérsékleten egy bizonyos határig nő.
-Mivel az enzimek Co-enzimeket és fémeket tartalmaznak, a p aránya a Co-enzimek és fémek koncentrációjától függ.
-jelenlét a rr-r-ben. aktivátorok és enzimgátlók.
A p-tions aránya betartja a törvényt, amely szerint a reakció gyorsabban halad, annál inkább a conc. in-ben. Tegyük fel, hogy van egy A + B C + D p-tion
v1 arányos a C és D v1 koncentrációjának A és B koncentrációjának termékével. k1 a sebességi állandó. ez a normalizált sebesség, azaz. egyenlő a p-ion arányával a reagensek koncentrációjában = 1.
Ha van kémiai egyensúly. azaz v1 = v-1, akkor írhatunk:
rossz - egyensúlyi konstans -a egyenlő az egyensúlyi egyensúlyi egyensúlyi állapot egyensúlyi állapotában.
25 állóállapot és a polienzim rendszerek osztályozása.
A teljes csere ciklus nyitott rendszer, a macska. Mindig külföldről érkeznek. A szervezetben átalakulnak és végtermékként eltávolítják őket. A biokémiai folyamatok szabályozását a sejtben közvetlen és visszacsatolás segítségével végezzük. A szabályozás célja a különböző sejtek koncentrációjának fenntartása a sejtben a szintben. macska. Ezt a sejt igényei határozzák meg. A legtöbb biokémiai reakciók által katalizált enzimek, így szabályozás mechanizmus változtatni az enzim aktivitása és koncentrációja. Polyfermental egy olyan rendszer a kapcsolódó enzimek, amelyek katalizálják különböző szakaszaiban az anyagcsere-folyamatokat. Ha a polienzim c-me koncentrációja minden komponensben. nevezetesen a p-tion enzim, szubsztrátja és termékei, az idő múlásával, állandóak maradnak. akkor állandósult állapotban van. Ellentétben a stacionárius egyensúlyi állapotban a, hogy az állami vezetékes h \ s c-edik állandó értéken tartjuk stacionárius áramlást a szigeteken és egy X állam-Xia const energia áramlását. A polienzim rendszerek összetétele lehet homogén és heterogén. A polienzimek legfontosabb folyamata a következő típusokba sorolható:
Külön-külön is elkülöníthetjük az önszabályozó c-ma (c-we visszacsatolással)
Szabadgyökös folyamatok biológiai rendszerekben
a biológiai folyamatokban mindenféle szintetikus műanyag IE energia a diszkrét, amelyben fontos szerepet játszik egy-elektron energia átvitelét és a kialakulását a paramágneses részecskék egyszeres vagy e-MI párosítatlan (szabad gyökök). A szabad gyökök nagyon aktívak. A páratlan elektronok száma és az atom szabad valenciájának fogalma közötti közvetlen identitás. Az in-va a páratlan e-bányákkal 2 grammra oszlik:
-in-va, amelyben a párosítatlan elektronok vagy az egész mólóhoz vagy annak legnagyobb részéhez kapcsolódnak. Ezek a párosítatlan elektronok erősen delokalizált molekuláris pályák mentén mozognak és nagymértékben aktiválják az atomok külső csoportjait.
-in-va, amelyben a párosítatlan elektronok egy atomhoz kötődnek egy molekulához. Nem mozognak azon molekuláris pályákon, amelyek az összes atomot lefedik. Az ilyen párosítatlan El-kötések. az átmeneti csoport atomjai (Fe, Co, Ni) / ezek a párosítatlan elektronok érdekesek a félvezető mechanizmusok tanulmányozásához.
Ez határozza meg
-monoradikusok egy párosítatlan El (OH-)
-biradicals, 2 páratlan Elmi.